След прерязване на периферен нерв на горния крайник и хирургично възстановяване, някои пациенти възстановяват добра сензомоторна функция, докато други не. Разбирането на периферните и централните механизми, които допринасят за възстановяването, може да улесни разработването на нови терапевтични интервенции. Пластичност след прерязване на периферен нерв е демонстрирана по цялата невроос при животински модели на увреждане на нервите. Въпреки това, мозъчните промени, които настъпват след прерязване на периферен нерв и хирургично възстановяване при хора, не са изследвани. Освен това, степента, до която регенерацията на периферните нерви влияе върху функционалните и структурни промени в мозъка, не е характеризирана. Затова попитахме дали функционалните промени са придружени от структурни промени на сивото и/или бялото вещество и дали тези промени са свързани със сензорното възстановяване? За да се справим с тези ключови проблеми, ние (i) оценихме регенерацията на периферните нерви; (ii) измерено активиране на мозъка при функционална магнитно-резонансна томография (сигнал, зависим от нивото на кислород в кръвта; BOLD) в отговор на вибротактилен стимул; (iii) изследва пластичността на структурата на сивото и бялото вещество на мозъка; и (iv) корелирани мерки за сензорно възстановяване с промени в сивото вещество при пациенти с трансекция на периферен нерв и хирургично възстановяване. В сравнение със здравия контралезионен нерв на всеки пациент, прерязаните нерви имат нарушена нервна проводимост 1.5 години след прерязване и възстановяване, провеждане с намалена амплитуда и повишена латентност. В сравнение със здрави контроли, пациентите с трансекция на периферен нерв и хирургично възстановяване са имали променена сигнална активност, зависима от нивото на кислород в кръвта, в контралезионната първична и вторична соматосензорна кора и в набор от мозъчни области, известни като „мрежа с положителна задача“. В допълнение, намаляването на сивото вещество беше идентифицирано в няколко области на мозъка, включително контралезионните първични и вторични соматосензорни кори, в същите области, където бяха идентифицирани намаления на сигнала, зависими от нивото на кислород в кръвта. Освен това, изтъняването на сивото вещество в постцентралната извивка е отрицателно свързано с мерките за сензорно възстановяване (механично и вибрационно откриване), което демонстрира ясна връзка между функция и структура. И накрая, ние идентифицирахме намалена фракционна анизотропия на бялото вещество в дясната инсула в регион, който също демонстрира намалено сиво вещество. Тези резултати дават представа за пластичността на мозъка и взаимоотношенията структура-функция-поведенчески след нараняване на нерва и имат важни терапевтични последици.
Ключови думи: кортикална дебелина; fMRI; дифузионно тензорно изображение; пластичност; увреждане на периферните нерви
Съкращения: BA=Brodmann area; BOLD=зависи от нивото на кислород в кръвта; fMRI=функционален магнитен резонанс;
PNIr=прерязване на периферен нерв и хирургично възстановяване; S1=първична соматосензорна кора; S2=вторична соматосензорна кора
Съдържание
Въведение
След трансекция на периферен нерв на горния крайник и хирургично възстановяване (PNIr), ?25% от пациентите не са се върнали на работа 1.5 години след операцията (Jaquet et al., 2001). В допълнение, 57% от пациентите с наранявания на нервите са на възраст между 16-35 години (McAllister et al., 1996); по този начин, дълъг живот на инвалидност и икономически трудности могат да придружават трансекцията на нерва на горния крайник. Разбирането на централните и периферните последици от увреждането на периферните нерви може да улесни разработването на нови терапевтични стратегии и програми за интервенция.
Не е известно как мозъкът реагира на PNIr при хората. Въпреки това, проучвания върху животни установяват, че пластичността в рамките на соматосензорната кора започва непосредствено след прерязване на периферния нерв и че 1 година след пълна нервна трансекция и хирургично възстановяване, кортикалните карти съдържат неравномерни, непродължителни представяния на прерязаните и съседните нерви (Wall et al. ., 1986). Смята се, че механизмите, които улесняват функционалната пластичност, включват незабавно демаскиране на вече съществуващи проекции от съседни кортикални и субкортикални нива и дългосрочно поникване на аксони на множество нива на невроос, включително първичната соматосензорна кора (S1) (Флоренция и Каас , 1995; Hickmott и Steen, 2005).
Изследванията с образна диагностика на човешкия мозък потвърдиха констатациите от животински модели с идентифицирането на променени функционални карти за активиране на ЯМР поради нараняване на гръбначния мозък, ампутация, прехвърляне от пръст на палеца и при пациенти със синдром на карпелния тунел (Lotze et al., 2001; Manduch et al., 2002; Jurkiewicz et al., 2006; Napadow et al., 2006). Освен това, структурните изследвания с ЯМР наскоро визуализираха промени в сивото и бялото вещество след травматични наранявания и при различни патологични състояния, включително ампутация на крайник и хронична болка (Apkarian et al., 2004; Draganski et al., 2006; Davis et al., 2008; Geha et al., 2008; май, 2008 г.). Смята се, че промените в сивото вещество са свързани с промени в размера на клетките, атрофия и/или загуба на неврони или глия, докато промените в бялото вещество се влияят от аксонална дегенерация и загуба на миелин (Beaulieu, 2002; май, 2008).
Мощен подход за очертаване на механизмите на патологията и пластичността е да се комбинират функционални и структурни техники за изобразяване на сивото и бялото вещество. По-рано съобщавахме, че пациентите с пълен PNIr на горния крайник запазват дълбоки соматосензорни дефицити, които продължават 41.5 години след операцията (Taylor et al., 2008a). Въз основа на тези открития, ние разсъждавахме, че тези пациенти ще проявят функционални и структурни промени в мозъка в ключови соматосензорни области на мозъка. Следователно, в това проучване ние предположихме, че пациентите с PNIr ще имат: (i) намалени реакции, зависими от нивото на кислород в кръвта (BOLD) на вибрационна стимулация на прерязаната нервна територия, в областта на S1, която представлява увредения горен крайник и във вторичния соматосензорна кора (S2); (ii) съответно намаляване на кортикалната дебелина в тези области на контралезионните S1 и S2; (iii) корелация между промените в дебелината на кората и психофизичните показатели на соматосензорната функция (прагове за откриване на вибрации и докосване); и (iv) намалена фракционна анизотропия (мярка за целостта на бялото вещество) в бялото вещество, захранващо се в/извън тези соматосензорни кортикални зони.
Методи
Учебни предмети
Ние набрахме 27 пациенти с пълна трансекция на медианния и/или улнарния нерв, последвано от хирургично възстановяване от пластични хирурзи, свързани с програмата за ръце на Университета в Торонто между юни 2006 г. и май 2008 г. От тази по-голяма група, 14 пациенти без болка (три жени , 11 мъже; 34 ± 10 години) с пълна трансекция на десния среден и/или улнарния нерв бяха включени в проучването [за да се избегнат обърквания, свързани с наличието на болка и латерални пациенти с болка (n=6) и левостранни лезии (n=7) бяха изключени от този анализ]. Всички пациенти са претърпели микрохирургично възстановяване на нервите най-малко 1.5 години преди включването в проучването (времето за възстановяване варира от 1.5 до 8 години). В допълнение, ние набрахме 14 здрави контроли, съответстващи на възрастта и пола (3 жени, 11 мъже; 34 ± 10 години). Всички субекти са дали информирано писмено съгласие за процедури, одобрени от Съвета по етика на изследванията на Университетската здравна мрежа. Всички субекти са били с дясна ръка (определено с помощта на инвентаризацията за ръкохватност в Единбург: Oldfield, 1971) и не са имали анамнеза за неврологични наранявания или хронична болка (или преди, или след прерязване на нерв). Вижте Таблица 1 за демографски подробности.
Уча дизайн
Всички субекти участваха в сесия за изобразяване, която включва: (i) функционална магнитно-резонансна томография (fMRI) в отговор на вибротактилни стимули, приложени към десния показалец (в рамките на територията на средния нерв); (ii) анатомично сканиране с висока разделителна способност на целия мозък, получено за регистрация на изображение и за анализ на кортикално сиво вещество; и (iii) две дифузионни тензорни образни сканирания за оценка на целостта на бялото вещество. Преди изобразяването, субектите бяха инструктирани за основния дизайн на експеримента и им беше напомнено да останат възможно най-неподвижни през цялото времетраене на сканирането.
Субектите бяха свободни да се оттеглят от изследването по всяко време. Освен това беше извършена сензорна и двигателна оценка за всички субекти (Taylor et al., 2008a). Тъй като праговете за откриване на докосване и вибрации са свързани с кортикалната дебелина, описание на тези методи е включено по-долу (други психофизични мерки ще бъдат докладвани другаде).
Праг на вибрация
Праговете за откриване на вибрации бяха определени с помощта на ръчен био-тезиометър (Bio-Medical Instrument Company, САЩ). Устройството има 12-милиметрова сонда, която е поставена върху дисталната фаланга на десния показалец (D2). Праговете бяха определени с помощта на метода на границите: амплитудата (напрежението) постепенно се увеличаваше, докато субектът не посочи, че възприема стимула. Праговете на вибрация бяха получени три пъти и беше изчислена средна стойност. По време на тестване на прага на вибрация, субектите бяха инструктирани да затворят очи и да опрат опакото на ръката си върху поддържаща възглавница.
Праг на механично откриване
Механичните прагове на откриване бяха определени с помощта на стандартизиран набор от влакна на von Frey (OptiHair2 Marstock Nervtest, Германия), съдържащи 12 логаритмично разположени калибрирани нишки, които доставят сили от 0.25-512 mN. Диаметърът на контактната повърхност на всичките 12 нишки е ~0.4 mm. Опитите бяха проведени със затворени очи на субекта и ръце, опряни върху мека възглавница. Пробите бяха приложени във възходяща серия и от субектите се изискваше да реагират всеки път, когато почувстват, че сонда докосва десния връх на пръста D2. Този процес се повтаря три пъти. Силата за нишката, която е била открита в поне две от трите опита, е докладвана като праг на механично откриване на този субект.
Тестване на нервната проводимост
Пациентите участваха в двустранни изследвания на сензорната и двигателната нервна проводимост в клиниката за електромиография (EMG) на Торонто Western Hospital. За проводимост на двигателния нерв стимулиращият електрод се поставя на китката и лакътя (отделно) и записващият електрод се поставя върху abductor pollicis brevis, за оценка на средния нерв, или abductor digiti minimi за оценка на улнарния нерв. За тестване на сензорния нерв записващият електрод се поставя на китката, а стимулиращият електрод се поставя на цифри D2, D3 и D5. Старши, опитен невролог от EMG клиниката на западната болница в Торонто (д-р Питър Ашби) прегледа всички клинични оценки, за да определи кои нерви показват нормални/ненормални реакции. Тъй като е известно, че мерките за амплитуда и латентност варират значително между субектите (поради фактори като плътността на инервацията, дълбочината на нерва и дебелината на кожата на отделния субект) (Kimura, 2001), непресечен нерв на всеки пациент служат като собствен контрол за сравнение със стойности от разсечената страна. При тези пациенти с откриваеми отговори на нервната проводимост са извършени сдвоени t-тестове, за да се оцени разликата в измерванията на латентността или амплитудата между пресечените и контралезионните нетрансектирани нерви на всеки пациент.
Параметри за изобразяване
Данните за образна диагностика на мозъка бяха получени с помощта на 3T GE MRI система, снабдена с осемканална фазирана намотка на главата. Субектите бяха поставени по гръб върху масата за ЯМР и главата на всеки субект беше подплатена, за да се намали движението. Данните за fMRI на целия мозък бяха получени с помощта на ехо планарно изображение (28 аксиални срезове, зрително поле (FOV) = 20 x 20 cm, 64 x 64 матрица, 3.125 x 3.125 x 4 mm воксели, време за ехо (TE) = 30 ms, повторение време (TR) = 2000 ms). Времето за сканиране беше 5 минути и 8 секунди (154 кадъра). По време на сканирането към дисталната фаланга на дясната D12 се прилага неболезнен, 2 Hz вибротактилен стимул с помощта на балонни диафрагми, задвижвани от сгъстен въздух (Устройство, произведено от д-р Христо Пантев; www.biomag.uni-muenster.de). Стимулите бяха доставени в блокове от 10 секунди, разпределени с 20 секунди почивка, за общо 10 блока стимулация и 10 блока почивка. Първите 8 s (4 TRs) данни, получени от всеки цикъл, бяха изхвърлени, за да се даде възможност за уравновесяване на сигнала на fMRI. Субектите бяха инструктирани да държат очите си затворени по време на сканиране и да се фокусират върху стимулите. Триизмерно (3D) анатомично сканиране с висока разделителна способност на целия мозък (124 сагитални резена, 24 x 24 cm FOV, 256 x 256 матрица, 1.5 x 0.94 x 0.94 mm воксели) беше получено с T1-претеглена градиентна 3D спойхо последователност (средно за един сигнал, ъгъл на обръщане = 20°, TE ?5 ms). В допълнение, две сканирания на дифузионния тензор (38 аксиални среза, FOV 24 x 24 cm, 128 x 128 матрица, 1.875 x 1.875 x 3 mm воксели) бяха получени по 23 посоки с b-стойност от 1000 smm 2. Всеки цикъл също съдържа два обема без дифузионно претегляне.
fMRI анализ
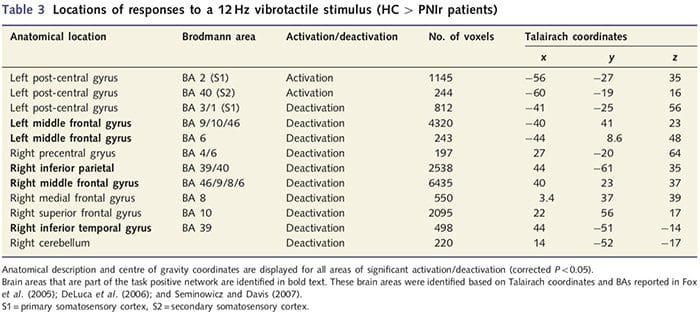
Данните бяха анализирани с помощта на Brainvoyager QX v1.8 (Brain Innovaton, Маастрихт, Холандия). Предварителната обработка включва: 3D корекция на движението, корекция на времето за сканиране на срез, премахване на линейна тенденция, високочестотно филтриране (пет цикъла на изпълнение) и пространствено изглаждане с 6 мм пълна ширина при половин максимум (FWHM) гаусово ядро. Наборите от данни за fMRI бяха интерполирани до 3 x 3 x 3 mm воксели, регистрирани към анатомичното изображение с висока разделителна способност и нормализирани към стандартното пространство на Talairach (Talairach and Tournoux, 1988). Вокселите се отчитат като 1 x 1 x 1 mm. Данните бяха анализирани с помощта на общия линеен модел; моделът е получен чрез конволюция на функцията boxcar на времевия ход на тактилната стимулация със стандартната функция на хемодинамичен отговор. За идентифициране между груповите разлики в моделите на активиране беше извършен анализ на фиксирани ефекти с контрастите: (i) здрави контроли: стимулация 4 почивка; (ii) PNIr: стимулация 4 почивка; и (iii) здрави контроли 4 PNIr. Картите за активиране бяха с праг на коригирана стойност от P50.05 (получени от некоригирани P50.0001 и 120 mm3 съседни воксели, както беше съобщено по-рано: Taylor and Davis, 2009); това също беше потвърдено чрез стартиране на симулация на Монте Карло с приложение AlphaSim, внедрено в софтуера за анализ на функционален неврообраз (AFNI). Този анализ включва само 11 пациенти, които са претърпели трансекция на десния среден нерв (n=9) или десния среден и улнарен нерв (n = 2) (т.е. тримата пациенти с чиста десен улнарен нерв не са включени в този анализ ).
Анализ на кортикалната дебелина
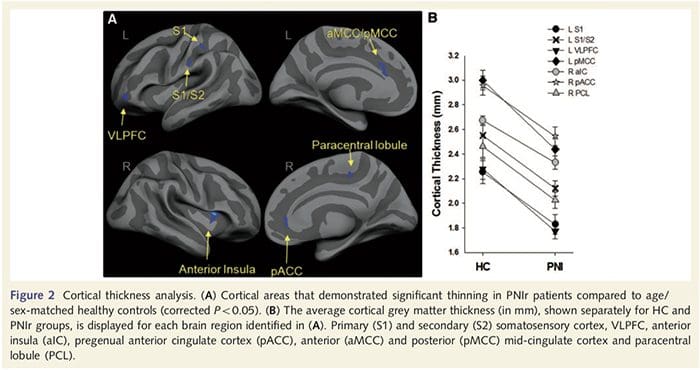
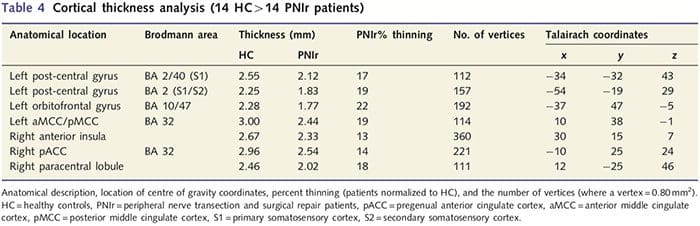
Анализът на кортикалната дебелина беше извършен с помощта на Freesurfer (http://surfer.nmr.mgh.harvard.edu); методите са описани подробно другаде (Dale et al., 1999; Fischl et al., 1999a, b; Fischl и Dale 2000). Накратко, T1-претеглени набори от анатомични данни с висока разделителна способност бяха регистрирани в атласа на Talairach (Talairach and Tournoux, 1988). Това е последвано от нормализиране на интензитета, отстраняване на черепа и отделяне на полукълба. Впоследствие границите на бяло/сиво вещество (наречено бяла повърхност) и сиво/CSF (наречено пиална повърхност) бяха идентифицирани и сегментирани. След това разстоянието между бялата и пиалната повърхности се изчислява във всяка точка във всяко полукълбо на мозъка. За да се идентифицират груповите разлики между 14-те пациенти и 14-те контроли, съответстващи на възраст/пол, беше извършен общ линеен моделен анализ във всяка точка на мозъка. Тъй като кортикалната топография на индивида по своята същност е хетерогенна, преди статистическия анализ беше приложено ядро за пространствено изглаждане на 5 mm FWHM. Данните се показват при коригиран P50.05 (извлечен от некоригиран P50.0075 и 102 съседни върха); това е изчислено чрез провеждане на симулация на Монте Карло с AlphaSim. Върхът представлява точка на двуизмерен лист и в това изследване разстоянието между два върха е 0.80 mm2.
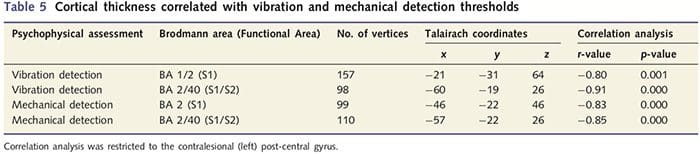
Тъй като пациентите показват значителен дефицит в соматосензорната функция в рамките на прерязаната нервна територия, ние предположихме, че мерките на соматосензорната функция (вибрация и откриване на докосване) ще корелират с дебелината на кората в контралезионния пост-централен гирус (първична и вторична соматосензорна кора). Следователно, ние извършихме корелационни анализи в групата пациенти между: (i) дебелина на кората и праг на откриване на вибрации; и (ii) дебелина на кората и прагове за откриване на докосване. Един пациент не е завършил психофизическата оценка; следователно, този анализ включва 13 пациенти с PNIr. В допълнение, за да се определи дали има връзка между дебелината на кората и времето за възстановяване, беше извършен и корелационен анализ между тези две мерки. Тези корелационни анализи бяха ограничени до контралезионния пост-централен гирус чрез включване на маска (взета от вградения в атласа на Freesurfer) в общия линеен модел. Беше извършена Монте Карло симулация, която беше ограничена до броя на върховете в контралезионния пост-централен гирус; изображенията се показват с коригиран P50.05 (извлечен от некоригиран P50.0075 и 68 съседни върха).
Дифузионен тензорен образен анализ
Обработката на изображения на дифузионен тензор беше извършена с DTiStudio (www.MriStudio.org) и FSLv.4.0 (www.fmrib.ox.ac.uk/fsl/). Изображенията за първи път бяха подравнени с инструмента за автоматична регистрация на изображения, внедрен в DTiStudio, като се използва първото B0 изображение от първата серия, придобито като шаблон. Този процес коригира движението на обекта и изкривяването на вихров ток. След това всички изображения бяха проверени визуално, за да се оцени качеството на изображението и подравняването на отделните дифузионни тензорни изображения. Ако беше открит артефакт, срезът беше премахнат преди да се изчисли средната стойност от двата отделни цикъла на изобразяване на дифузионния тензор. Индивидуалните FA карти бяха изчислени с помощта на инструмента DTIFIT, внедрен във FSL. Извършен е статистически анализ на воксел за идентифициране на груповите разлики в средната фракционна анизотропия, като се използва пространствена статистика, базирана на тракт; за пълно описание на тези методи вижте Smith et al. (2006). Накратко, изображенията бяха нелинейно регистрирани към целево изображение (MNI152), средното изображение беше създадено от всички набори от данни и това изображение впоследствие беше изтънено, за да представи всички трактове, които бяха общи за всички субекти. След това най-високите стойности на фракционната анизотропия на всеки субект бяха проектирани върху скелета чрез търсене в бяло вещество, перпендикулярно на всяка точка от скелета на бялото вещество. След това беше извършен статистически анализ на вокселите на целия мозък между групите (14PNIr и 14 здрави контроли) и изображенията бяха коригирани на целия мозък при P50.05. В допълнение, беше извършен анализ на област от интерес в бяло вещество трактати в непосредствена близост до контралатералния S1, таламуса и двустранната предна и задна инсула. Тези региони са избрани, тъй като по-рано са били замесени в аспектите на соматосензацията и защото съответстват на региони, които са идентифицирани в груповите анализи на fMRI и анализа на кортикалната дебелина (CTA). Регионите на интерес бяха нарисувани върху скелета на бялото вещество, както следва: (i) Контралатералният участък на S1, представляващ интерес, произхожда медиално от кръстовището между скелета на бялото вещество на corona-radiata и скелетната секция, захранваща се в постцентралната гируса; завършващ в края на тракта в рамките на даден отрязък.
В посока z областта на интерес се простира от z=49 до 57; трактове от бяло вещество, захранващи областта на ръката. (ii) Контралатералната област на таламуса, която представлява интерес, беше ограничена до следи от бяло вещество, обграждащи задните и медиалните таламични ядра (ядра, участващи в соматосензорната функция), простиращи се от z = 1 до 4. (iii) Островните региони, представляващи интерес, бяха изтеглени двустранно в рамките на бяло вещество в съседство с предната и задната инсула въз основа на критерии, публикувани преди това от нашата лаборатория (Taylor et al., 2008b). Областта на интерес се разшири от z = 2 до 8. Стойностите на фракционната анизотропия бяха извлечени от всеки от тези региони на интерес и беше извършен многовариантен анализ на дисперсията (MANOVA), като се използва Статистически пакет за социални науки v13.0 (SPSS Inc, Чикаго), който включва стойности на дробна анизотропия за всичките шест региона на интерес.
Резултати
Таблица 1 предоставя демографски подробности за участниците в проучването. Всичките 14 пациенти са претърпели пълна трансекция на десния среден и/или улнарния нерв, последвана от микрохирургично възстановяване най-малко 1.5 години преди включването в проучването. Времето от операцията до изследването варира от 1.5 до 8 години със средна стойност (?SD) от 4.8 ? 3 години. Пациентите и контролите не (34 ± 10 години и двете групи; t = 0.04; P = 0.97).
Психофизика
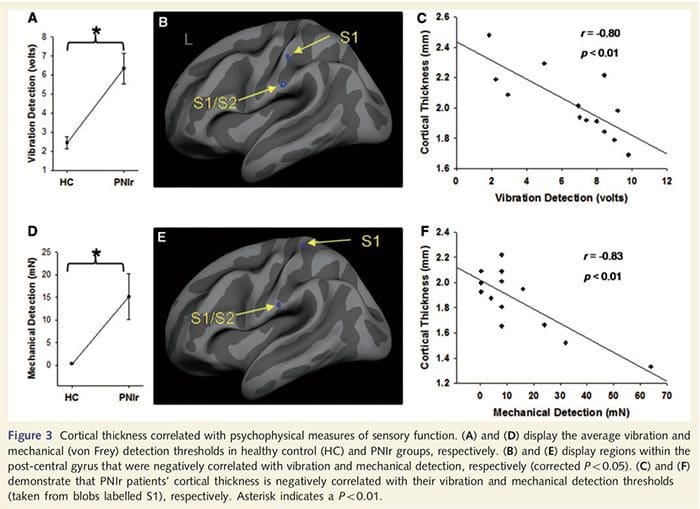
Праговете на вибрация бяха изчислени от трите измервания, тъй като анализът на дисперсията с еднопосочни многократни измервания (ANOVA) не показва значителни разлики между трите опита [F (25, 1)=0.227, P=0.64]. Праговете на вибрация и механично откриване са значително нарушени при пациенти с PNIr в сравнение със здрави контроли (вибрация: t = 4.77, P50.001, фиг. 3A; механични: t=3.10, P=0.005, фиг. 3D).
Тестване на нервната проводимост
Измерванията за амплитуда и латентност, получени от контралезионните нерви на всеки пациент, бяха класифицирани като нормални от опитен невролог в EMG Clinic в Торонто Western Hospital. Девет от 14-те пациенти завършиха изследване на нервната проводимост. Таблица 2 показва средните данни за увеличение/намаляване на латентността и амплитудата за проводимост на сензорния нерв от китката към мускулите на abductor pollicis brevis (медиана) или abductor digiti minimi (улнарни) и за сензорна проводимост от китката до D2 (медиана) и D5 ( улнарна) в сравнение с всеки пациент неувреден контралезионен нерв. От девет, седем пациенти са имали трансекции, които включват медианния нерв. От тези седем, един пациент не е имал откриваем отговор по време на моторно тестване, а друг пациент не е имал откриваем отговор по време на сензорно тестване.
 При шестте пациенти с откриваеми отговори, латентностите на двигателната проводимост са увеличени с 43% (t=6.2; P=0.002) и амплитудите са намалени с 38% (t= 2.6; P=0.045), когато прекъснатият нерв на всеки пациент е бил в сравнение с тяхната ненаранена страна. Сензорната проводимост в медианните нерви също разкрива 26% увеличение на латентността (t=3.9; P=0.011) и 73% намаление на амплитудата (t= 8.0; P=0.000) в сравнение с нормалните контралезионни нерви. При четиримата пациенти с трансекции на улнарния нерв един пациент не е имал откриваем отговор по време на тестване на сензорния нерв. При тези пациенти с отговори, латентността на улнарния нерв не е била значително повишена (t = 2.8; P = 0.070); обаче амплитудите бяха значителни
При шестте пациенти с откриваеми отговори, латентностите на двигателната проводимост са увеличени с 43% (t=6.2; P=0.002) и амплитудите са намалени с 38% (t= 2.6; P=0.045), когато прекъснатият нерв на всеки пациент е бил в сравнение с тяхната ненаранена страна. Сензорната проводимост в медианните нерви също разкрива 26% увеличение на латентността (t=3.9; P=0.011) и 73% намаление на амплитудата (t= 8.0; P=0.000) в сравнение с нормалните контралезионни нерви. При четиримата пациенти с трансекции на улнарния нерв един пациент не е имал откриваем отговор по време на тестване на сензорния нерв. При тези пациенти с отговори, латентността на улнарния нерв не е била значително повишена (t = 2.8; P = 0.070); обаче амплитудите бяха значителни
намалява с 41% (t = 5.9; P = 0.010). Сензорното тестване на улнарния нерв показва 27% увеличение на латентността (t = 4.3; P = 0.049), но без значително увеличение на амплитудата (t = ?3.5; P = 0.072).
Функционална пластичност в първичната соматосензорна кора
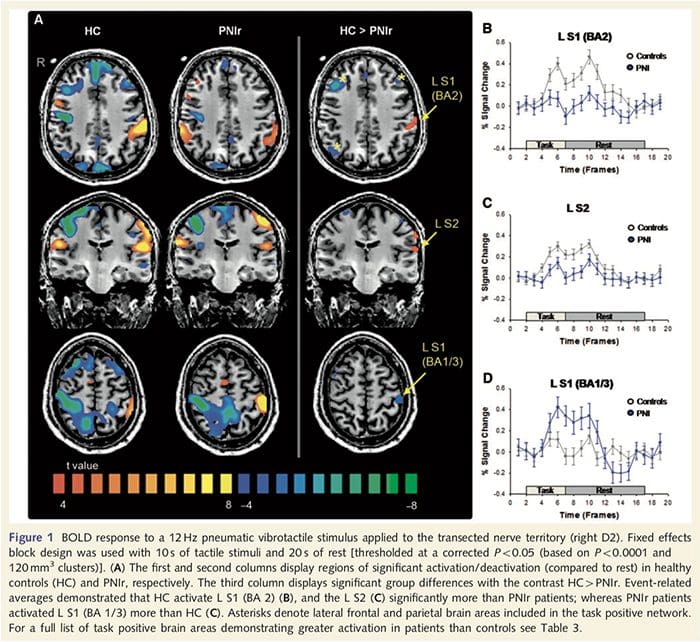
Функционалните MRI карти бяха изчислени от 11 пациенти с PNIr с десни медианни нервни трансекции (пациентите с трансекции на улнарния нерв бяха изключени от този анализ) и 11 здрави контроли, съответстващи на възрастта и пола. От фиг. 1А става ясно, че пациентите с PNIr имат значително по-малко активиране, в сравнение със здрави контроли, в област S1, съответстваща на зона на Brodmann 2 (BA2) (Talairach and Tournoux, 1988) и S2 (вижте таблица 3 за подробности) . Средните отговори, свързани със събитието от тези региони на интерес, подчертават отслабения BOLD отговор в левия BA2 и левия S2 на пациентите (фиг. 1B и C, съответно). Любопитно е, че вибротактилната стимулация при пациентите активира по-висока част от постцентралната извивка (вероятно BA1/3) (Talairach and Tournoux, 1988) (Фиг. 1А и Таблица 3). Средната стойност, свързана със събитие (фиг. 1D) показва, че здравите контроли са имали минимално активиране в този регион. Освен това пациентите са имали значително повече активиране в мозъчните региони, общо известни като мрежа с положителна задача (звездички на Фиг. 1). Вижте Таблица 3 за пълния списък на активираните мозъчни зони с положителни резултати. Тази мрежа включва латерална префронтална, латерална париетална, премоторна и долна темпорална кора (Таблица 3): мозъчни зони, които се активират по време на изпълнение на задача, изискваща внимание и се потискат или неактивират по време на почивка или задачи, които не са предизвикателство за когнитивното или вниманието (Fox et. al., 2005; DeLuca et al., 2006; Seminowicz и Davis 2007).
Намаленото сиво вещество в първичната соматосензорна кора корелира със сензорното възстановяване
Анализът на кортикалната дебелина при всичките 14 пациенти и 14 здрави контроли, съответстващи на възраст/пол, разкри няколко локуса на значително изтъняване на кората в групата на PNIr (Фиг. 2 и Таблица 4). По-конкретно, пациентите са имали 13%-22% намаление на дебелината на кората в лявата (контралезионна) S1, S2, прегенуалната предна цингулатна извивка, вентролатералната префронтална кора и дясната предна инсула, предната/задна средна цингулатна извивка и парацентралния лобул. Интересно е, че местата на изтъняване на сивото вещество в постцентралната извивка съвпадат с областите на намален BOLD след вибротактилна стимулация (Таблица 4). Тъй като имахме предварителни познания за сензорния дефицит на пациентите и времето за възстановяване (т.е. времето след микрохирургичното възстановяване), след това попитахме дали дебелината на кората на пациентите в постцентралната гируса корелира с техните сензорни механични и вибрационни прагове за откриване, или с техните време за възстановяване. Тези анализи разкриха отрицателна корелация между дебелината на кората и праговете за откриване на вибрации в регион, обхващащ BA1/2 и S2 (P50.001, r=?0.80 и ?0.91, за BA1/2 и S2, съответно; Фиг. 3 и Таблица 5 ). В допълнение, праговете на механично откриване също са в отрицателна корелация с дебелината на кората в малко по-добра BA2 област и същата S2 област (P50.001, r = ?0.83 и ?0.85, съответно за BA2 и S2; Фиг. 3 и Таблица 5). Въпреки това, ние не идентифицирахме значителна връзка между времето за възстановяване и дебелината на кората. Следователно, в постцентралната извивка кортикалното изтъняване е свързано с по-тежки сензорни дефицити. Въпреки това, ние не идентифицирахме значителна връзка между времето за възстановяване и дебелината на кората. Отново имаше съответствие между кортикалното изтъняване в области, които са отрицателно корелирани с вибрационни стимули и регионите, показващи групови fMRI и CTA аномалии.
Аномалии на бялото вещество след прерязване на нерв
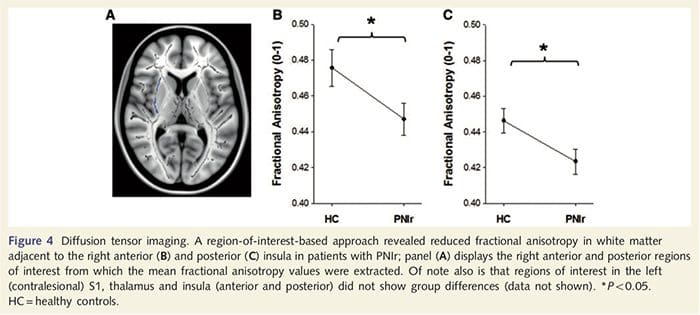
За да оценим целостта на бялото вещество, ние използвахме подход за регион на интерес, за да изследваме разликите в групите на бялото вещество въз основа на априорни хипотези. Регионите на интерес бяха ограничени до трактове на бяло вещество, заобикалящи и захранващи се в контралезионния S1 и таламуса. В допълнение, ние също така нарисувахме области на интерес в бялото вещество, съседни на лявата и дясната, предната и задната инсула. Инсулата беше избрана, тъй като е замесена в соматосензорната обработка и защото идентифицирахме намалено сиво вещество в дясната предна островна част с CTA. Този подход към областта на интерес разкрива, че пациентите имат значително намалени стойности на фракционната анизотропия на бялото вещество (MANOVA, включително всичките шест области на интерес), съседни на дясната предна част [F (1, 26) = 4.39, P = 0.046; Фиг. 4А] и задна инсула [F (1, 26) = 5.55, P = 0.026; Фиг. 4В], но няма групови разлики в бялото вещество в съседство с лявата инсула (лява предна инсула: P = 0.51; лява задна инсула: P=0.26), таламус (P=0.46) или S1 (P=0.46 ).
 Дискусия
Дискусия
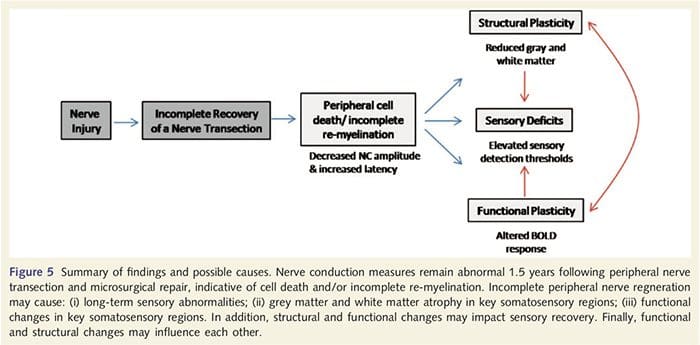
Тук за първи път демонстрирахме, че има функционална пластичност и структурни аномалии както на сивото, така и на бялото вещество в няколко кортикални области след трансекция на периферен нерв на горния крайник и хирургично възстановяване. Тази пластичност може да възникне от непълна регенерация на периферните нерви (периферна клетъчна смърт и/или непълна ремиелинизация), тъй като мерките за нервна проводимост при тези пациенти показват тежки аномалии. В допълнение, нашите данни показват, че намалените вибротактилно предизвикани fMRI отговори в постцентралната извивка съответстват на изтъняване на сивото вещество в групата пациенти. Тези резултати предполагат, че намалените BOLD отговори могат да бъдат улеснени от намаляване на кортикалното сиво вещество и/или намаляване на аферентния вход към постцентралния гирус. В допълнение, дебелината на кората в същите тези части на постцентралната извивка отрицателно корелира с поведенческите мерки на соматосензорната функция. Тоест, повишеният соматосензорен дефицит е свързан с по-тънък кортекс; и двете може да са свързани с аферентния вход. Взети заедно, нашите данни предполагат, че непълната регенерация на периферните нерви допринася за соматосензорни увреждания, кортикална атрофия на сивото вещество и намалено активиране на fMRI (виж Фиг. 5 за обобщение на тези открития).
Добре известно е, че кортикалната пластичност след прерязване на периферен нерв и хирургично възстановяване може да се случи в цялата ЦНС при нечовекоподобни примати (Kaas, 1991). Смята се, че тази пластичност се дължи на демаскирането на по-рано безшумни синапси или аксонално поникване в деаферентирана територия (Wall et al., 1986; Florence and Kaas, 1995). В модела на примати, 1 година след прерязване на нерв и хирургично възстановяване, денервираната кора се характеризира с непълни и безпорядъчни представяния на регенерираните и съседните (непокътнати) нерви. Това неравномерно представяне се приписва на непълна периферна регенерация, водеща до частично възстановяване на денервираното кортикално пространство (Kaas, 1991). За да оценим степента на периферна регенерация в нашата популация от пациенти, ние проведохме изследвания на проводимостта на сензорните и двигателните нерви в трансектираната област. Нашите резултати от нервната проводимост показват, че пациентите с PNIr имат значително намалена амплитуда и повишена латентност както в сетивните, така и в двигателните нерви в сравнение със собствената им нетрансектирана страна. Намалената амплитуда, съчетана с повишена латентност, е показателна за загуба на периферни фибри (т.е. клетъчна смърт) и/или анормална или непълна ремиелинизация след трансекция (Kimura, 1984). В допълнение, добре е установено, че между 20% и 50% от ганглийните неврони на дорзалния корен умират след прерязване на нерв (Liss et al., 1996). По този начин, аферентната клетъчна смърт и непълната регенерация могат да доведат до намален аферентен вход към кората, което може да е причина за продължаващи сензорни дефицити и намален BOLD отговор в BA2 и S2. Освен това, този намален аферентен вход може също да обясни изтъняването на кората, което наблюдавахме в същите региони на кората. Доказано е, че сензорната депривация причинява трансневронна дегенерация в няколко области на ЦНС, включително дорзалния рог след седалищния нерв (Knyihar-Csillik et al., 1989) и може да включва неврони от втори и трети ред (Powell и Ерулкар, 1962). Трансневронната дегенерация се характеризира със свиване на клетките и се смята, че е свързана с намален или несъществуващ аферентен вход (Knyihar-Csillik et al., 1989). По този начин загубата на кортикално сиво вещество (или атрофия) също може да бъде пряко свързана с намален аферентен вход.
 Ние също така демонстрирахме повишено активиране в постцентралната извивка в регион, съответстващ на BA1/3 (Talairach and Tournoux, 1988). Електрофизиологични, анатомични и невровизуални изследвания установиха, че за повечето кожни механорецептивни аференти първите кортикални дестинации са BA1 и BA3b. Всяка от тези цитоархитектонични области на мозъка притежава соматотопна телесна карта с малки рецептивни полета. В допълнение, тези области отговарят на много характеристики на тактилната информация, като текстура и грапавост, скорост и кривина на стимулите (Bodegard et al., 2001). Изследванията на fMRI показват, че активността в соматосензорната кора се влияе от вниманието, така че fMRI отговорите на тактилни стимули в S1 се увеличават, когато субектите се обръщат към тактилен стимул, но се отслабват, когато субектите са разсеяни (Arthurs et al., 2004; Porro et al., 2004). Освен това, нашите пациенти активираха мрежа от мозъчни области, известна като мрежа за положителна задача (DeLuca et al., 2006), повече от здрави контроли. Тези мозъчни зони се активират по време на процеси, изискващи внимание (Fox et al., 2005; Seminowicz and Davis, 2007). Заедно тези открития предполагат, че пациентите трябва да се грижат повече за стимула, отколкото за контролите, поради увредения им сензорен вход. Това повишено внимание може също да обясни повишеното активиране в BA1/3b. Разбира се, повишеното активиране в BA1/3b може също да отразява пластичността, която не е свързана с натоварването на вниманието.
Ние също така демонстрирахме повишено активиране в постцентралната извивка в регион, съответстващ на BA1/3 (Talairach and Tournoux, 1988). Електрофизиологични, анатомични и невровизуални изследвания установиха, че за повечето кожни механорецептивни аференти първите кортикални дестинации са BA1 и BA3b. Всяка от тези цитоархитектонични области на мозъка притежава соматотопна телесна карта с малки рецептивни полета. В допълнение, тези области отговарят на много характеристики на тактилната информация, като текстура и грапавост, скорост и кривина на стимулите (Bodegard et al., 2001). Изследванията на fMRI показват, че активността в соматосензорната кора се влияе от вниманието, така че fMRI отговорите на тактилни стимули в S1 се увеличават, когато субектите се обръщат към тактилен стимул, но се отслабват, когато субектите са разсеяни (Arthurs et al., 2004; Porro et al., 2004). Освен това, нашите пациенти активираха мрежа от мозъчни области, известна като мрежа за положителна задача (DeLuca et al., 2006), повече от здрави контроли. Тези мозъчни зони се активират по време на процеси, изискващи внимание (Fox et al., 2005; Seminowicz and Davis, 2007). Заедно тези открития предполагат, че пациентите трябва да се грижат повече за стимула, отколкото за контролите, поради увредения им сензорен вход. Това повишено внимание може също да обясни повишеното активиране в BA1/3b. Разбира се, повишеното активиране в BA1/3b може също да отразява пластичността, която не е свързана с натоварването на вниманието.
 BA2 и S2 получават проекции от BA1/3b, а също и от различни части на вентропостериорния таламичен комплекс (Pons et al., 1985; Friedman and Murray, 1986). И двете мозък областите имат големи, често многоцифрени (BA2) или двустранни (S2) рецептивни полета (Pons et al., 1985; Iwamura et al., 2002). Въз основа на анатомични проекции и свойства на невронния отговор, йерархичната обработка на тактилна информация е демонстрирана от BA1/3b до BA 2 (Kaas et al., 2002). В допълнение, електрофизиологични изследвания при макаци (Pons et al., 1987) и магнитоенцефалографски данни, получени при хора, предполагат, че серийната обработка на тактилни входове се случва от S1 до S2 при висши примати (Frot and Mauguiere 1999; Disbrow et al. ., 2001). Няколко проучвания показват, че BA2 се активира предимно от форма и кривина (Bodegard et al., 2001), докато S2 може да участва в тактилното обучение (Ridley and Ettlinger 1976; Murray and Mishkin, 1984), подкрепяйки идеята, че тези мозъчни области участват в соматосензорната обработка от по-висок порядък. Нашата психофизическа оценка показа, че пациентите са значително увредени при откриването на прости тактилни стимули и в теста за идентификация на текстурата на формата 1.5 години след операцията (Taylor et al., 2008a). Последният тест оценява способността на пациента да разпознава характеристиките на обект, докато активно изследва форма или текстура, което изисква интегриране на сензорна информация в региони на тялото (Rosen and Lundborg, 1998). Взети заедно, една интерпретация на нашите данни е, че пациентите с PNIr обръщат повече внимание на вибротактилния стимул, което води до повишено активиране на положителната мрежа и BA1/3. Въпреки това, при тези пациенти, нашите данни предполагат, че областите за обработка от по-висок порядък, като BA2 и S2, не са получили тактилна информация, което от своя страна може да доведе до изтъняване на кората и намалени BOLD отговори.
BA2 и S2 получават проекции от BA1/3b, а също и от различни части на вентропостериорния таламичен комплекс (Pons et al., 1985; Friedman and Murray, 1986). И двете мозък областите имат големи, често многоцифрени (BA2) или двустранни (S2) рецептивни полета (Pons et al., 1985; Iwamura et al., 2002). Въз основа на анатомични проекции и свойства на невронния отговор, йерархичната обработка на тактилна информация е демонстрирана от BA1/3b до BA 2 (Kaas et al., 2002). В допълнение, електрофизиологични изследвания при макаци (Pons et al., 1987) и магнитоенцефалографски данни, получени при хора, предполагат, че серийната обработка на тактилни входове се случва от S1 до S2 при висши примати (Frot and Mauguiere 1999; Disbrow et al. ., 2001). Няколко проучвания показват, че BA2 се активира предимно от форма и кривина (Bodegard et al., 2001), докато S2 може да участва в тактилното обучение (Ridley and Ettlinger 1976; Murray and Mishkin, 1984), подкрепяйки идеята, че тези мозъчни области участват в соматосензорната обработка от по-висок порядък. Нашата психофизическа оценка показа, че пациентите са значително увредени при откриването на прости тактилни стимули и в теста за идентификация на текстурата на формата 1.5 години след операцията (Taylor et al., 2008a). Последният тест оценява способността на пациента да разпознава характеристиките на обект, докато активно изследва форма или текстура, което изисква интегриране на сензорна информация в региони на тялото (Rosen and Lundborg, 1998). Взети заедно, една интерпретация на нашите данни е, че пациентите с PNIr обръщат повече внимание на вибротактилния стимул, което води до повишено активиране на положителната мрежа и BA1/3. Въпреки това, при тези пациенти, нашите данни предполагат, че областите за обработка от по-висок порядък, като BA2 и S2, не са получили тактилна информация, което от своя страна може да доведе до изтъняване на кората и намалени BOLD отговори.
Предполага се, че островната инсула играе роля в интегрирането на мултимодална информация, важна за сензомоторните, емоционалните, алостатичните/хомеостатични и когнитивните функции (Devinsky et al., 1995; Critchley, 2004; Craig, 2008) и е определена като лимбична сензорна кора (Craig , 2008 г.). Няколко проучвания съобщават за инсуларно активиране в отговор на тактилна стимулация (Gelnar et al., 1998;
Downar et al., 2002) и анатомичните проучвания при примати показват, че островната инсула е реципрочно свързана с челните, теменните и темпоралните дялове (Augustine, 1996). При нашите пациенти дясната предна инсула беше единствената кортикална област, която демонстрира значително изтъняване на кората във връзка с намалени стойности на фракционна анизотропия в съседното бяло вещество, което предполага, че кортикалното изтъняване в този регион е свързано със загуба на влакна, излизащи към или от тази структура. Дясната предна инсула е замесена в интероцепцията, тъй като е разположена да интегрира хомеостатичния вход от тялото с мотивационни, емоционални и социални условия (Craig, 2008). Освен това, Critchley et al. (2004) съобщават за корелация между интероцептивните способности и обема на сивото вещество на дясната предна инсула. Като се има предвид нашето откритие, че пациентите имат намалено сиво вещество в дясната предна инсула, би било интересно да се оцени интероцептивните способности след увреждане на периферния нерв в бъдещо проучване.
Взети заедно, ние демонстрирахме за първи път, че функционалните и структурни промени присъстват в човешката мозъчна кора 1.5 години след пълно разрязване на периферен нерв на горния крайник, който беше микрохирургично ремонтиран. Освен това измерванията на нервната проводимост показват непълна периферна регенерация при тези пациенти. Освен това, ние показваме, че дебелината на кората е свързана с психофизичните мерки за възстановяване, тъй като по-тънкият кортекс в рамките на BA2 и S2 е свързан с по-лоша соматосензорна функция. Тези данни предполагат, че възстановяването на нормални функционални карти на активиране е пряко свързано с успешната регенерация на периферните аференти.
Кери С. Тейлър, 1,2 Димитри Дж. Анастакис2,3,4 и Карън Д. Дейвис1,2,3
1 отдел на мозъка, изображенията и поведението – системна невронаука, Западен изследователски институт в Торонто, Университетска здравна мрежа, Торонто, Канада M5T258
2 Институт по медицински науки, Университет на Торонто, Канада
3 Катедра по хирургия, Университет на Торонто, Канада
4 Ресурсен център за клинични изследвания, Западен изследователски институт в Торонто, Университетска здравна мрежа, Торонто, Канада M5T2S8
Кореспонденция на: Karen D. Davis, Ph.D.,
Отдел по мозъци, изображения и поведение – системна невронаука, Западен изследователски институт в Торонто,
Западна болница в Торонто,
Университетска здравна мрежа,
Стая MP14-306, 399 Bathurst Street,
Торонто, Онтарио,
Канада M5T 2S8
Мейл: kdavis@uhnres.utoronto.ca
Благодарности
Авторите благодарят на г-н Джеф Поуп, д-р Ейдриън Кроули, г-н Юджийн Хласни и г-н Кийт Та за експертната техническа помощ. Авторите биха искали да благодарят на д-р Питър Ашби и г-н Фреди Пейз от EMG Clinic на западната болница в Торонто за провеждането на тестовете за нервна проводимост и за предоставянето на експертна оценка на констатациите. Авторите също така благодарят на д-р Двали, Бинхамер, Фиалков и Антонишин за сътрудничеството с този проект. Д-р Дейвис е изследователски катедра в Канада в областта на мозъка и поведението (CIHR MOP 53304).
Финансиране
The Physicians Services Incorporated и съвместна субсидия за семена от Центъра за изследване на болката на Университета в Торонто/ AstraZeneca.
Допълнителен материал
Допълнителен материал е достъпен в Brain онлайн.
празен
Литература:
Apkarian AV, Sosa Y, Sonty S, et al. Хроничната болка в гърба е свързана с
намалена префронтална и таламична плътност на сивото вещество. J Neurosci
2004 г.; 24: 10410 5.
Артърс OJ, Йохансен-Берг H, Matthews PM, Boniface SJ. Внимание
диференциално модулира свързването на fMRI BOLD и предизвикано
потенциални амплитуди на сигнала в човешката соматосензорна кора 7.
Exp Brain Res 2004; 157: 269.
Августин младши Схема и функционални аспекти на островния лоб
при примати, включително хора. Brain Res Brain Res Rev 1996; 22:
229 44.
Beaulieu C. Основата на анизотропната водна дифузия в нервната
система – технически преглед. NMR Biomed 2002; 15: 435.
Bodegard A, Geyer S, Grefkes C, Zilles K, Roland PE. Йерархичен
обработка на тактилна форма в човешкия мозък. Neuron 2001; 31:
317 28.
Крейг АД. Интероцепция и емоция: невроанатомична перспектива.
В: Люис М, Хавиланд-Джоунс Дж, Барет Л, редактори. Наръчник на
емоции. Ню Йорк: Guildford Press; 2008. с. 272 87.
Кричли HD. Човешката кора отговаря на интероцептивно предизвикателство.
Proc Natl Acad Sci USA 2004; 101: 6333 4.
Critchley HD, Wiens S, Rotshtein P, Ohman A, Dolan RJ. Невронни системи
подпомагане на интероцептивното осъзнаване. Nat Neurosci 2004; 7: 189.
Дейл AM, Fischl B, Sereno MI. Кортикален повърхностен анализ. I. Сегментиране
и реконструкция на повърхността. Neuroimage 1999; 9: 179.
Davis KD, Pope G, Chen J, Kwan CL, Crawley AP, Diamant NE. Кортикална
изтъняване при IBS: последици за хомеостатичния ефект, вниманието и болката
обработка. Неврология 2008; 70: 153 4.
DeLuca M, Beckmann CF, De SN, Matthews PM, Smith SM. fMRI в покой
държавните мрежи дефинират различни режими на взаимодействия на дълги разстояния
в човешкия мозък. Neuroimage 2006; 29: 1359.
Devinsky O, Morrell MJ, Vogt BA. Приноси на предната цингулат
кората към поведението. Мозък 1995; 118 (Pt 1): 279 306.
Disbrow E, Roberts T, Poeppel D, Krubitzer L. Доказателство за интерхемискъла
обработка на входове от ръцете в човешки S2
и PV. J Neurophysiol 2001; 85: 2236 44.
Даунар Дж., Кроули АП, Микулис диджей, Дейвис К.Д. Чувствителна кортикална мрежа
за изява на стимули в неутрален поведенчески контекст в множество
сетивни модалности. J Neurophysiology 2002; 87: 615.
Драгански B, Moser T, Lummel N, et al. Намаляване на таламичното сиво
въпрос след ампутация на крайник. Neuroimage 2006; 31: 951.
Фишл Б, Дейл АМ. Измерване на дебелината на човешката мозъчна кора
от магнитно-резонансни изображения. Proc Natl Acad Sci USA 2000; 97:
11050 5.
Fischl B, Sereno MI, Dale AM. Кортикален повърхностен анализ. II:
Надуване, сплескване и координатна система, базирана на повърхността.
Neuroimage 1999a; 9: 195.
Fischl B, Sereno MI, Tootell RB, Dale AM. Междупредмет с висока разделителна способност
осредняване и координатна система за кортикалната повърхност. Хъм Мозък
Mapp 1999b; 8: 272.
Florence SL, Kaas JH. Мащабна реорганизация на множество нива на
соматосензорният път следва терапевтичната ампутация на ръката
при маймуни. J Neurosci 1995; 15: 8083.
Фокс MD, Snyder AZ, Vincent JL, Corbetta M, Van E, Raichle ME. В
човешкият мозък е вътрешно организиран в динамичен, антикорелиран
функционални мрежи. Proc Natl Acad Sci USA 2005; 102: 9673 9678.
Фридман DP, Мъри EA. Таламична свързаност на втория
соматосензорната област и съседните соматосензорни полета на
странична бразда на макака. J Comp Neurol 1986; 252: 348.
Frot M, Mauguiere F. Време и пространствено разпределение на соматосензорните
отговори, записани в горния бряг на силвиевата фисура (SII зона) в
хора. Cereb Cortex 1999; 9: 854.
Geha PY, Baliki MN, Harden RN, Bauer WR, Parrish TB, Apkarian AV.
Мозъкът при хронична CRPS болка: анормално сиво-бяло вещество
взаимодействия в емоционални и автономни области. Neuron 2008; 60:
570 81.
Gelnar PA, Krauss BR, Szeverenyi NM, Apkarian AV. Представяне на върха на пръстите
в човешката соматосензорна кора: изследване с fMRI.
Neuroimage 1998; 7: 261.
Hickmott PW, Steen PA. Мащабни промени в дендритната структура
по време на реорганизация на соматосензорната кора на възрастните. Nat Neurosci
2005 г.; 8: 140 42.
Iwamura Y, Tanaka M, Iriki A, Taoka M, Toda T. Обработка на
тактилни и кинестетични сигнали от двустранните страни на тялото в
постцентрален гирус на будни маймуни. Behav Brain Res 2002; 135:
185 90.
Jaquet JB, Luijsterburg AJ, Kalmijn S, Kuypers PD, Hofman A, Hovius SE.
Наранявания на среден, лакътен и комбиниран медианно-улнарен нерв: функционални
резултат и връщане към производителността. J Trauma 2001; 51: 687.
Jurkiewicz MT, Crawley AP, Verrier MC, Fehlings MG, Mikulis DJ.
Соматосензорна кортикална атрофия след увреждане на гръбначния мозък: базирана на воксел
изследване на морфометрията. Неврология 2006; 66: 762 4.
Каас JH. Пластичност на сензорни и двигателни карти при възрастни бозайници. Ану
Rev Neurosci 1991; 14: 137.
Каас JH, Jain N, Qi HX. Организацията на соматосензорната система в
примати. В: Nelson RJ, редактор. Соматосензорната система.
Вашингтон, окръг Колумбия: CRC Press; 2002. с. 1 25.
Кимура Дж. Електродиагностика при заболявания на нервите и мускулите: принципи
и практика. Оксфорд: Oxford University Press; 2001 г.
Кимура Дж. Принципи и капани на изследванията на нервната проводимост. Ан Нейрол
1984 г.; 16: 415 29.
Knyihar-Csillik E, Rakic P, Csillik B. Трансневронална дегенерация при
Роландовата субстанция на гръбначния мозък на примата, предизвикана от
индуцирана от аксотомия трансганглионна дегенеративна атрофия на централната
първични сензорни терминали. Cell Tissue Res 1989; 258: 515.
Liss AG, af Ekenstam FW, Wiberg M. Загуба на неврони в дорзалния корен
ганглии след прерязване на периферен сензорен нерв. Анатомичен
изучаване при маймуни. Scand J Plast Reconstr Surg Hand Surg 1996; 30: 1 6.
Lotze M, Flor H, Grodd W, Larbig W, Birbaumer N. Фантомни движения
и болка. Изследване с fMRI при ампутирани горни крайници. Мозък 2001;
124: 2268.
Manduch M, Bezuhly M, Anastakis DJ, Crawley AP, Mikulis DJ. Сериен
fMRI на адаптивни промени в първичната сензомоторна кора
реконструкция на палеца. Неврология 2002; 59: 1278 81.
Май А. Хроничната болка може да промени структурата на мозъка. Болка 2008 г.;
137: 7.
McAllister RM, Gilbert SE, Calder JS, Smith PJ. Епидемиологията и
лечение на наранявания на периферните нерви на горните крайници в съвременен
практика. J Hand Surg (Br) 1996; 21: 4.
Мъри EA, Mishkin M. Относителен принос на SII и area5 към тактилните
дискриминация при маймуни 2. Behav Brain Res 1984; 11: 67.
Нападов V, Кетнър Н, Райън А, Куонг К.К., Одет Дж., Хуи К.К.
Соматосензорна кортикална пластичност при синдром на карпалния тунел - напречно сечение
fMRI оценка. Neuroimage 2006; 31: 520.
Oldfield RC. Оценка и анализ на ръчността: Единбург
складова наличност. Neuropsychologia 1971; 9: 97.
Pons TP, Garraghty PE, Cusick CG, Kaas JH. Соматотопната организация
на площ 2 при маймуни макаки 6. J Comp Neurol 1985; 241: 445.
Pons TP, Garraghty PE, Friedman DP, Mishkin M. Физиологични доказателства
за серийна обработка в соматосензорната кора. Наука 1987; 237:
417 20.
Porro CA, Lui F, Facchin P, Maieron M, Baraldi P. Свързана с възприятието активност
в човешката соматосензорна система: функционален магнитен резонанс
образни изследвания. Magn Reson Imaging 2004; 22: 1539.
Пауъл TP, Erulkar S. Трансневронна клетъчна дегенерация в слуха
релейни ядра на котката. J Anat 1962; 96: 249.
Ridley RM, Ettlinger G. Нарушено тактилно учене и задържане след
отстраняване на втората соматична сензорна проекционна кора (SII) в
маймуна. Brain Res 1976; 109: 656.
Rosen B, Lundborg G. Нов инструмент за тактилен гнозис в чувствителността
тестване. J Hand Ther 1998; 11: 251 7.
Семинович Д.А., Дейвис К.Д. Болката подобрява функционалната свързаност
на мозъчна мрежа, предизвикана от изпълнение на когнитивна задача.
J Neurophysiol 2007; 97: 3651 9.
Smith SM, Jenkinson M, Johansen-Berg H, et al. Пространствено базирано на тракт
статистика: вокселен анализ на многопредметни дифузионни данни.
Neuroimage 2006; 31: 1487.
Talairach J, Tournoux P. Копланарен стереотаксичен атлас на човешкия мозък.
Ню Йорк: Thieme Medical Publishers Inc.; 1988 г.
Тейлър KS, Anastakis DJ, Davis KD. Хронична болка след периферна
увреждането на нервите е свързано с катастрофиране на болката и невротизъм.
Int Ass Stud Pain 2008a; 267.
Тейлър KS, Дейвис KD. Стабилност на тактилната и свързана с болката fMRI
мозъчни активации: изследване на зависими от прага и
независими от прага методи. Hum Brain Mapp 2009; 30:
1947 62.
Тейлър KS, Seminowicz DA, Davis KD. Две системи на състояние на покой
връзка между инсулата и зъбната кора. Хъм Мозък
Map 2008b;DOI:10.1002/hbm.20705.
Wall JT, Kaas JH, Sur M, Nelson RJ, Felleman DJ, Merzenich MM.
Функционална реорганизация в соматосензорните кортикални зони 3b и 1
на възрастни маймуни след възстановяване на средния нерв: възможна връзка с
сензорно възстановяване при хората. J Neurosci 1986; 6: 218.
Затворете акордеон
Професионален обхват на практика *
Информацията тук на "Прерязването на нерва ви променя мозъка ви | Ел Пасо, Тексас." няма за цел да замени личната връзка с квалифициран здравен специалист или лицензиран лекар и не е медицински съвет. Насърчаваме ви да вземате здравни решения въз основа на вашите изследвания и партньорство с квалифициран здравен специалист.
Информация за блога и дискусии за обхват
Нашият информационен обхват е ограничено до хиропрактика, мускулно-скелетни, физически лекарства, уелнес, допринасящи етиологични висцерозоматични нарушения в рамките на клинични презентации, свързана соматовисцерална рефлексна клинична динамика, сублуксационни комплекси, чувствителни здравни проблеми и/или статии, теми и дискусии от функционална медицина.
Ние предоставяме и представяме клинично сътрудничество със специалисти от различни дисциплини. Всеки специалист се ръководи от своя професионален обхват на практика и своята юрисдикция за лицензиране. Използваме протоколи за функционално здраве и уелнес за лечение и поддържане на грижи за наранявания или нарушения на мускулно-скелетната система.
Нашите видеоклипове, публикации, теми, теми и прозрения обхващат клинични въпроси, проблеми и теми, които се отнасят до и пряко или косвено подкрепят нашия клиничен обхват на практика.*
Нашият офис разумно се е опитал да предостави подкрепящи цитати и е идентифицирал съответното научно изследване или проучвания, подкрепящи нашите публикации. Ние предоставяме копия на подкрепящи научни изследвания, достъпни за регулаторните съвети и обществеността при поискване.
Разбираме, че обхващаме въпроси, които изискват допълнително обяснение как може да подпомогне определен план за грижи или протокол за лечение; следователно, за да обсъдите допълнително темата по-горе, моля не се колебайте да попитате Д-р Алекс Хименес, окръг Колумбия, Или се свържете с нас на адрес 915-850-0900.
Ние сме тук, за да помогнем на вас и вашето семейство.
Благословения
Д-р Алекс Хименес н.е., MSACP, RN*, CCST, IFMCP*, CIFM*, ATN*
имейл: coach@elpasofunctionalmedicine.com
Лицензиран като доктор по хиропрактика (DC) в Тексас & Ню Мексико*
Тексас DC Лиценз # TX5807, Ню Мексико DC Лиценз # NM-DC2182
Лицензирана като регистрирана медицинска сестра (RN*) in Флорида
Флорида Лиценз RN Лиценз # RN9617241 (Контролен номер 3558029)
Компактен статус: Многодържавен лиценз: Упълномощен да практикува в 40 състояния*
Д-р Алекс Хименес DC, MSACP, RN* CIFM*, IFMCP*, ATN*, CCST
Моята цифрова визитка