Неврогенно възпаление, или NI, е физиологичният процес, при който медиаторите се изхвърлят директно от кожните нерви, за да започне възпалителен отговор. Това води до създаване на локални възпалителни реакции, включително еритема, подуване, повишаване на температурата, чувствителност и болка. Фините немиелинизирани аферентни соматични С-влакна, които реагират на механични и химични стимули с ниска интензивност, са до голяма степен отговорни за освобождаването на тези възпалителни медиатори.
Когато се стимулират, тези нервни пътища в кожните нерви освобождават енергийни невропептиди или вещество Р и пептид, свързан с калцитонин ген (CGRP), бързо в микросредата, предизвиквайки серия от възпалителни реакции. Има значителна разлика в имуногенното възпаление, това е първият защитен и репаративен отговор, направен от имунната система, когато патоген навлезе в тялото, докато неврогенното възпаление включва пряка връзка между нервната система и възпалителните реакции. Въпреки че неврогенното възпаление и имунологичното възпаление могат да съществуват едновременно, двете не са клинично неразличими. Целта на статията по-долу е да обсъди механизма на неврогенното възпаление и ролята на периферната нервна система в защитата на гостоприемника и имунопатологията.
Съдържание
Неврогенно възпаление - ролята на периферната нервна система в защитата на гостоприемника и имунопатологията
абстрактен
Традиционно се смята, че периферната нервна и имунна система изпълняват отделни функции. Тази линия обаче става все по-замъглена от нови прозрения за неврогенното възпаление. Ноцицепторните неврони притежават много от същите пътища за молекулярно разпознаване на опасност като имунните клетки и в отговор на опасността периферната нервна система директно комуникира с имунната система, образувайки интегриран защитен механизъм. Плътната инервационна мрежа от сензорни и автономни влакна в периферните тъкани и високата скорост на невронната трансдукция позволяват бърза локална и системна неврогенна модулация на имунитета. Периферните неврони също изглежда играят значителна роля в имунната дисфункция при автоимунни и алергични заболявания. Следователно, разбирането на координираното взаимодействие на периферните неврони с имунните клетки може да подобри терапевтичните подходи за повишаване на защитата на гостоприемника и потискане на имунопатологията.
Въведение
Преди две хиляди години Целз дефинира възпалението като включващо четири основни признака - Dolor (болка), Calor (топлина), Rubor (зачервяване) и Tumor (подуване), наблюдение, което показва, че активирането на нервната система е признато за неразделна част от възпаление. Оттогава обаче болката се смята основно за симптом, а не като участник в генерирането на възпаление. В тази перспектива ние показваме, че периферната нервна система играе пряка и активна роля в модулирането на вродения и адаптивния имунитет, така че имунната и нервната системи могат да имат обща интегрирана защитна функция в защитата на гостоприемника и отговора на увреждане на тъканите, сложен взаимодействие, което също може да доведе до патология при алергични и автоимунни заболявания.
Оцеляването на организмите е критично зависимо от способността да се изгради защита срещу потенциална вреда от увреждане на тъканите и инфекция. Защитата на гостоприемника включва както поведение на избягване за премахване на контакт с опасна (вредна) среда (невронна функция), така и активно неутрализиране на патогени (имунна функция). Традиционно ролята на имунната система в борбата с инфекциозните агенти и възстановяването на увреждането на тъканите се счита за доста различна от тази на нервната система, която преобразува увреждащите сигнали от околната среда и вътрешните сигнали в електрическа активност, за да произведе усещания и рефлекси (фиг. 1). Ние предлагаме тези две системи всъщност да са компоненти на единен защитен механизъм. Соматосензорната нервна система е идеално разположена за откриване на опасност. Първо, всички тъкани, които са силно изложени на външна среда, като епителни повърхности на кожата, белите дробове, пикочните и храносмилателния тракт, са плътно инервирани от ноцицептори, сензорни влакна, произвеждащи болка с висок праг. Второ, трансдукцията на вредни външни стимули е почти мигновена, с порядък по-бързо от мобилизирането на вродената имунна система и следователно може да бъде „първият отговор“ в защитата на гостоприемника.
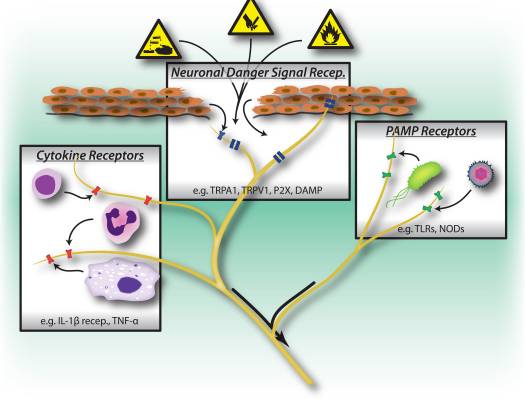
Фигура 1: Вредните стимули, микробните и възпалителните пътища на разпознаване предизвикват активиране на периферната нервна система. Сензорните неврони притежават няколко средства за откриване на наличието на вредни/вредни стимули. 1) Рецепторите за сигнал за опасност, включително TRP канали, P2X канали и рецептори, свързани с молекулярни модели (DAMP), разпознават екзогенни сигнали от околната среда (напр. топлина, киселинност, химикали) или ендогенни сигнали за опасност, освободени по време на травма/тъканно увреждане (напр. АТФ, пикочна киселина, хидроксиноненали). 2) Рецепторите за разпознаване на модели (PRRs), като Toll-подобни рецептори (TLRs) и Nod-подобни рецептори (NLRs) разпознават свързани с патогена молекулярни модели (PAMPs), отделени от нахлуващи бактерии или вируси по време на инфекция. 3) Цитокиновите рецептори разпознават фактори, секретирани от имунните клетки (напр. IL-1beta, TNF-alpha, NGF), които активират карт кинази и други сигнални механизми за повишаване на възбудимостта на мембраната.
В допълнение към ортодромните входове към гръбначния мозък и мозъка от периферията, потенциалите на действие в ноцицепторните неврони могат също да се предават антидромно в точките на разклонение обратно към периферията, аксоновия рефлекс. Те, заедно с продължителни локални деполяризации, водят до бързо и локално освобождаване на невронни медиатори както от периферните аксони, така и от терминалите (фиг. 2) 1. Класически експерименти на Goltz (през 1874 г.) и на Bayliss (през 1901 г.) показват, че електрически стимулиращи дорзалните корени индуцира вазодилатация на кожата, което води до концепцията за „неврогенно възпаление”, независимо от това, което се произвежда от имунната система (фиг. 3).
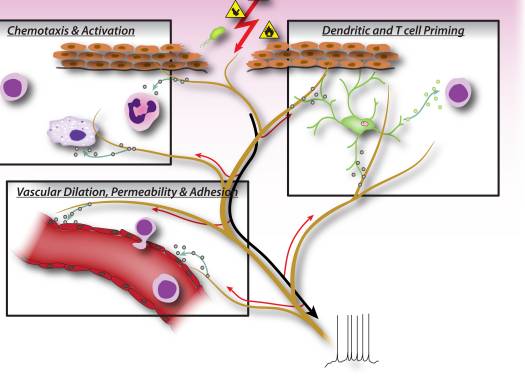
Фигура 2: Невронните фактори, освободени от ноцицепторните сензорни неврони, директно управляват левкоцитния хемотаксис, съдовата хемодинамика и имунния отговор. Когато вредните стимули активират аферентни сигнали в сетивните нерви, се генерират антидромни аксонни рефлекси, които индуцират освобождаването на невропептиди в периферните терминали на невроните. Тези молекулярни медиатори имат няколко възпалителни действия: 1) Хемотаксис и активиране на неутрофили, макрофаги и лимфоцити до мястото на нараняване и дегранулация на мастоцити. 2) Сигнализиране към съдовите ендотелни клетки за увеличаване на притока на кръв, съдово изтичане и оток. Това също така позволява по-лесно набиране на възпалителни левкоцити. 3) Праймиране на дендритни клетки за стимулиране на последваща диференциация на Т-хелперни клетки в подтипове Th2 или Th17.

Фигура 3: Хронология на напредъка в разбирането на неврогенните аспекти на възпалението от Целз до наши дни.
Неврогенното възпаление се медиира от освобождаването на невропептидите калцитонин ген свързан пептид (CGRP) и вещество P (SP) от ноцицепторите, които действат директно върху васкуларните ендотелни и гладкомускулните клетки 2�5. CGRP предизвиква вазодилатационни ефекти 2, 3, докато SP увеличава пропускливостта на капилярите, което води до плазмена екстравазация и оток 4, 5, допринасяйки за rubor, calor и тумор на Celsus. Ноцицепторите обаче освобождават много допълнителни невропептиди (онлайн база данни: www.neuropeptides.nl/), включително адреномедулин, неврокинини A и B, вазоактивен чревен пептид (VIP), невропептид (NPY) и гастрин освобождаващ пептид (GRP), както и други молекулярни медиатори като глутамат, азотен оксид (NO) и цитокини като еотаксин 6.
Сега оценяваме, че медиаторите, освободени от сензорните неврони в периферията, не само действат върху васкулатурата, но също така директно привличат и активират вродени имунни клетки (мастоцити, дендритни клетки) и адаптивни имунни клетки (Т-лимфоцити) 7 12. В острата обстановка на увреждане на тъканите, ние предполагаме, че неврогенното възпаление е защитно, улеснявайки физиологичното заздравяване на рани и имунната защита срещу патогени чрез активиране и набиране на имунни клетки. Въпреки това, такива невро-имунни комуникации също вероятно играят основна роля в патофизиологията на алергичните и автоимунните заболявания чрез усилване на патологични или неадаптивни имунни отговори. В животински модели на ревматоиден артрит, например, Levine и колеги са показали, че денервацията на ставата води до поразително отслабване на възпалението, което зависи от невронната експресия на вещество P 13, 14. В последните проучвания на алергично възпаление на дихателните пътища, колит и псориазис, първичните сензорни неврони играят централна роля в инициирането и увеличаването на активирането на вродения и адаптивен имунитет 15 17.
Ето защо ние предполагаме, че периферната нервна система не само играе пасивна роля в защитата на гостоприемника (откриване на вредни стимули и иницииране на поведение на избягване), но също така и активна роля съвместно с имунната система в модулирането на отговорите и борбата с вредните стимули, роля, която може да бъде подкопана, за да допринесе за болестта.
Споделени пътища за разпознаване на опасностите в периферната нервна и вродена имунна система
Периферните сензорни неврони са приспособени да разпознават опасността за организма поради своята чувствителност към интензивни механични, термични и дразнещи химически стимули (фиг. 1). Йонните канали с преходен рецепторен потенциал (TRP) са най-широко изследваните молекулярни медиатори на ноцицепцията, провеждащи неселективно навлизане на катиони при активиране от различни вредни стимули. TRPV1 се активира от високи температури, ниско pH и капсаицин, валиноидният дразнещ компонент на лютите чушки 18. TRPA1 медиира откриването на реактивни химикали, включително дразнители на околната среда като сълзотворен газ и промишлени изотиоцианати 19, но по-важното е, че се активира и по време на тъкан увреждане от ендогенни молекулярни сигнали, включително 4-хидроксиноненал и простагландини 20, 21.
Интересно е, че сензорните неврони споделят много от същите рецепторни пътища за молекулярно разпознаване на патогени и опасност като вродените имунни клетки, което им позволява да откриват и патогени (фиг. 1). В имунната система микробните патогени се откриват чрез рецептори за разпознаване на модели, кодирани от зародишна линия (PRR), които разпознават широко запазени молекулярни модели, свързани с екзогенни патогени (PAMPs). Първите PRR, които бяха идентифицирани, бяха членове на семейството на toll-like рецептори (TLR), които се свързват с дрожди, бактериални компоненти на клетъчната стена и вирусна РНК 22. След активирането на PRR, сигналните пътища надолу по веригата се включват, които индуцират производство и активиране на цитокини на адаптивен имунитет. В допълнение към TLRs, вродените имунни клетки се активират по време на увреждане на тъканите чрез ендогенни сигнали за опасност, известни също като свързани с увреждане молекулярни модели (DAMPs) или алармини 23, 24. Тези сигнали за опасност включват HMGB1, пикочна киселина и освободени протеини от топлинен шок чрез умиране на клетки по време на некроза, активиране на имунните клетки по време на неинфекциозни възпалителни реакции.
PRRs, включително TLRs 3, 4, 7 и 9, се експресират от ноцицепторни неврони, а стимулацията от TLR лиганди води до индуциране на вътрешни токове и сенсибилизация на ноцицепторите към други стимули на болка 25-27. Освен това, активирането на сензорните неврони от TLR7 лиганда имиквимод води до активиране на специфичен за сърбеж сензорен път 25. Тези резултати показват, че свързаната с инфекцията болка и сърбеж може отчасти да се дължат на директно активиране на невроните от фактори, получени от патогени, които от своя страна активира имунните клетки чрез периферно освобождаване на невронни сигнални молекули.
Основен DAMP/алармин, освободен по време на клетъчно увреждане, е АТФ, който се разпознава от пуринергичните рецептори както на ноцицепторните неврони, така и на имунните клетки 28-30. Пуринергичните рецептори са съставени от две семейства: P2X рецептори, лиганд-зависими катионни канали и P2Y рецептори, G-протеин свързани рецептори. В ноцицепторните неврони, разпознаването на АТФ става чрез P2X3, което води до бързо десенсибилизиращи катионни токове и болка 28, 30 (Фиг. 1), докато P2Y рецепторите допринасят за активиране на ноцицептор чрез сенсибилизация на TRP и волтаж-зависимите натриеви канали. В макрофагите свързването на АТФ с P2X7 рецепторите води до хиперполяризация и активиране надолу по веригата на инфламазомата, молекулен комплекс, важен за генерирането на IL-1beta и IL-18 29. Следователно, АТФ е мощен сигнал за опасност, който активира както периферните неврони, така и вродените. имунитет по време на нараняване, а някои доказателства дори предполагат, че невроните експресират части от възпалената молекулярна машина 31.
Обратната страна на сигналите за опасност в ноцицепторите е ролята на TRP каналите в активирането на имунните клетки. TRPV2, хомолог на TRPV1, активиран от вредна топлина, се експресира при високи нива във вродените имунни клетки 32. Генетичната аблация на TRPV2 доведе до дефекти в макрофаговата фагоцитоза и изчистване на бактериални инфекции 32. Мастоцитите също експресират TRPV канали, които могат директно да медиират тяхната дегранулация 33. Остава да се определи дали ендогенните сигнали за опасност активират имунните клетки по подобен начин като ноцицепторите.
Ключово средство за комуникация между имунните клетки и ноцицепторните неврони са чрез цитокините. При активиране на цитокиновите рецептори, пътищата на сигнална трансдукция се активират в сензорните неврони, което води до фосфорилиране надолу по веригата на мембранни протеини, включително TRP и волтаж-зависими канали (фиг. 1). Получената сенсибилизация на ноцицепторите означава, че нормално безобидни механични и топлинни стимули вече могат да активират ноцицепторите. Интерлевкин 1 бета и TNF-алфа са два важни цитокина, освободени от вродените имунни клетки по време на възпаление. IL-1beta и TNF-alpha се усещат директно от ноцицептори, които експресират сродните рецептори, индуцират активиране на p38 map кинази, което води до повишена възбудимост на мембраната 34-36. Нервният растежен фактор (NGF) и простагландин Е(2) също са основни възпалителни медиатори, освободени от имунните клетки, които действат директно върху периферните сензорни неврони, за да предизвикат сенсибилизация. Важен ефект от сенсибилизацията на ноцицептор от имунни фактори е повишеното освобождаване на невропептиди в периферните терминали, които допълнително активират имунните клетки, като по този начин предизвикват положителна обратна връзка, която задвижва и улеснява възпалението.
Сензорна нервна система Контрол на вродения и адаптивния имунитет
В ранните фази на възпалението сензорните неврони сигнализират до резидентни в тъканта мастоцити и дендритни клетки, които са вродени имунни клетки, важни за инициирането на имунния отговор (фиг. 2). Анатомичните изследвания показват директно слагане на терминали с мастоцити, както и с дендритни клетки, а невропептидите, освободени от ноцицепторите, могат да предизвикат дегранулация или производство на цитокини в тези клетки 7, 9, 37. Това взаимодействие играе важна роля при алергичните дихателни пътища възпаления и дерматити 10 12.
По време на ефекторната фаза на възпалението, имунните клетки трябва да намерят пътя си към специфичното място на нараняване. Много медиатори, освободени от сензорни неврони, невропептиди, хемокини и глутамат, са хемотактични за неутрофили, еозинофили, макрофаги и Т-клетки и засилват ендотелната адхезия, което улеснява насочването на имунните клетки 6, 38 41 (фиг. 2). Освен това, някои доказателства предполагат, че невроните могат директно да участват в ефекторната фаза, тъй като самите невропептиди могат да имат директни антимикробни функции 42.
Сигналните молекули, получени от неврони, могат също да насочват вида на възпалението, като допринасят за диференциацията или спецификацията на различни видове адаптивни имунни Т клетки. Антигенът се фагоцитира и обработва от вродени имунни клетки, които след това мигрират до най-близкия лимфен възел и представят антигенния пептид на наивните Т клетки. В зависимост от вида на антигена, костимулиращите молекули върху вродената имунна клетка и комбинациите от специфични цитокини, наивните Т клетки узряват в специфични подтипове, които най-добре служат на възпалителните усилия за изчистване на патогенния стимул. CD4 Т клетките или Т хелперните (Th) клетки могат да бъдат разделени на четири основни групи, Th1, Th2, Th17 и Т регулаторни клетки (Treg). Th1 клетките участват главно в регулирането на имунните отговори към вътреклетъчните микроорганизми и органоспецифичните автоимунни заболявания; Th2 са критични за имунитета срещу извънклетъчни патогени, като хелминти, и са отговорни за алергични възпалителни заболявания; Th17 клетките играят централна роля в защитата срещу микробни предизвикателства, като извънклетъчни бактерии и гъбички; Treg клетките участват в поддържането на самотолерантност и регулирането на имунните отговори. Този процес на съзряване на Т-клетките изглежда е силно повлиян от сензорни невронни медиатори. Невропептидите, като CGRP и VIP, могат да отклонят дендритните клетки към Th2-тип имунитет и да намалят имунитета от Th1-тип чрез насърчаване на производството на определени цитокини и инхибиране на други, както и чрез намаляване или засилване на миграцията на дендритни клетки към локални лимфни възли 8 , 10, 43. Сензорните неврони също допринасят значително за алергично (предимно Th2 задвижвано) възпаление 17. В допълнение към регулирането на Th1 и Th2 клетките, други невропептиди, като SP и Hemokinin-1, могат да стимулират възпалителния отговор повече към Th17 или Treg 44, 45, което означава, че невроните също могат да участват в регулирането на възпалителното разрешаване. При имунопатологии като колит и псориазис, блокадата на невронни медиатори като субстанция P може значително да потисне Т-клетките и имунно медиирано увреждане 15, въпреки че антагонизирането на един медиатор може само по себе си да има само ограничен ефект върху неврогенното възпаление.
Като се има предвид, че сигналните молекули, освободени от периферните сетивни нервни влакна, регулират не само малките кръвоносни съдове, но и хемотаксиса, самонасочването, узряването и активирането на имунните клетки, става ясно, че невро-имунните взаимодействия са много по-сложни, отколкото се смяташе досега (фиг. . 2). Освен това е напълно възможно, че не отделни невронни медиатори, а по-скоро специфични комбинации от сигнални молекули, освободени от ноцицепторите, влияят на различни етапи и типове имунни отговори.
Автономен рефлексен контрол на имунитета
Ролята на рефлексната верига на холинергичната автономна нервна система в регулирането на периферните имунни отговори също изглежда важна 46. Блуждаещият нерв е главният парасимпатиков нерв, свързващ мозъчния ствол с висцералните органи. Работата на Кевин Трейси и други сочат мощни генерализирани противовъзпалителни реакции при септичен шок и ендотоксемия, предизвикани от активност на еферентния вагусов нерв, водеща до потискане на периферните макрофаги 47. Вагусът активира периферните адренергични неврони на цьолиакния ганглий, инервиращи далака, което води до освобождаване на ацетилхолин надолу по веригата, който се свързва с алфа-49 никотиновите рецептори на макрофагите в далака и стомашно-чревния тракт. Това предизвиква активиране на сигналния път на JAK7/STAT2 SOCS3, който силно потиска TNF-алфа транскрипцията 3. Адренергичният цьолиакен ганглий също комуникира директно с подгрупа от ацетилхолин, произвеждащи памет Т-клетки, които потискат възпалителните макрофаги 47.
Инвариантните естествени Т-клетки убийци (iNKT) са специализирана подгрупа от Т-клетки, които разпознават микробни липиди в контекста на CD1d вместо пептидни антигени. NKT клетките са ключова лимфоцитна популация, участваща в борбата с инфекциозни патогени и регулирането на системния имунитет. NKT клетките се намират и транспортират главно през васкулатурата и синусоидите на далака и черния дроб. Симпатичните бета-адренергични нерви в черния дроб директно сигнализират за модулиране на NKT клетъчната активност 50. По време на миши модел на инсулт (MCAO), например, мобилността на чернодробните NKT клетки беше видимо потисната, което беше обърнато от симпатиковата денервация или бета-адренергичните антагонисти. Освен това, тази имуносупресивна активност на норадренергичните неврони върху NKT клетките доведе до увеличаване на системната инфекция и увреждане на белите дробове. Следователно, еферентните сигнали от автономните неврони могат да медиират мощна имуносупресия.

Прозрение на д-р Алекс Химензе
Неврогенното възпаление е локален възпалителен отговор, генериран от нервната система. Смята се, че играе основна роля в патогенезата на различни здравословни проблеми, включително мигрена, псориазис, астма, фибромиалгия, екзема, розацея, дистония и множествена химическа чувствителност. Въпреки че неврогенното възпаление, свързано с периферната нервна система, е широко изследвано, концепцията за неврогенно възпаление в централната нервна система все още се нуждае от допълнителни изследвания. Според няколко изследователски проучвания обаче се смята, че дефицитът на магнезий е основната причина за неврогенно възпаление. Следващата статия демонстрира преглед на механизмите на неврогенно възпаление в нервната система, което може да помогне на здравните специалисти да определят най-добрия подход за лечение за грижа за различни здравни проблеми, свързани с нервната система.
Заключения
Какви са съответните специфични роли на соматосензорната и вегетативната нервна система в регулирането на възпалението и имунната система (фиг. 4)? Активирането на ноцицепторите води до локални аксонни рефлекси, които локално набират и активират имунните клетки и следователно са предимно про-възпалителни и пространствено ограничени. Обратно, автономната стимулация води до системна имуносупресия, като засяга групите от имунни клетки в черния дроб и далака. Аферентните сигнални механизми в периферията, водещи до задействане на имуносупресивната вагусова холинергична рефлексна верига, са слабо разбрани. Въпреки това, 80-90% от вагусните влакна са първични аферентни сензорни влакна и следователно сигналите от вътрешните органи, много от които потенциално се задвижват от имунни клетки, могат да доведат до активиране на интерневрони в мозъчния ствол и чрез тях до изход в еферентни вагусни влакна 46.
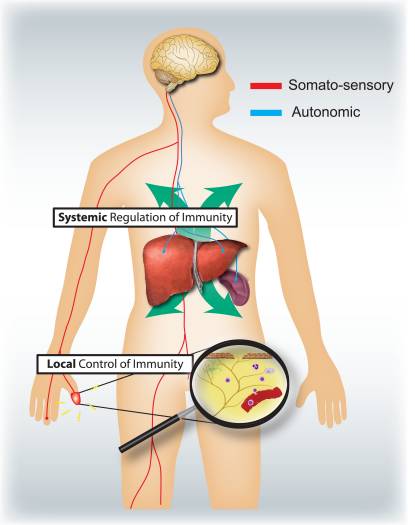
Фигура 4: Сетивната и вегетативната нервна система модулират съответно местните и системните имунни отговори. Ноцицепторите, инервиращи епителните повърхности (напр. кожа и бели дробове), предизвикват локализирани възпалителни реакции, активирайки мастоцитите и дендритните клетки. При алергично възпаление на дихателните пътища, дерматит и ревматоиден артрит ноцицепторните неврони играят роля в задвижването на възпалението. Обратно, автономните вериги, инервиращи висцералните органи (напр. далака и черния дроб), регулират системните имунни отговори, като блокират активирането на макрофагите и NKT клетките. При инсулт и септична ендотоксемия тези неврони играят имуносупресивна роля.
Обикновено времето и естеството на възпалението, независимо дали по време на инфекция, алергични реакции или автоимунни патологии, се определят от категориите участващи имунни клетки. Ще бъде важно да знаете какви различни видове имунни клетки се регулират от сензорни и автономни сигнали. Систематична оценка на това какви медиатори могат да бъдат освободени от ноцицепторите и автономните неврони и експресията на рецепторите за тях от различни вродени и адаптивни имунни клетки може да помогне за решаването на този въпрос.
По време на еволюцията са се развили подобни молекулярни пътища за откриване на опасност както за вродения имунитет, така и за ноцицепцията, въпреки че клетките имат напълно различни линии на развитие. Докато PRRs и вредните лиганд-зависими йонни канали се изследват отделно от имунолози и невробиолози, границата между тези две полета е все по-размита. По време на увреждане на тъканите и патогенна инфекция, освобождаването на сигнали за опасност вероятно ще доведе до координирано активиране както на периферните неврони, така и на имунните клетки със сложна двупосочна комуникация и интегрирана защита на гостоприемника. Анатомичното позициониране на ноцицепторите в интерфейса с околната среда, скоростта на невронната трансдукция и способността им да освобождават мощни коктейли от имунодействащи медиатори позволяват на периферната нервна система активно да модулира вродения имунен отговор и да координира адаптивния имунитет надолу по веригата. Обратно, ноцицепторите са силно чувствителни към имунни медиатори, които активират и сенсибилизират невроните. Следователно неврогенното и имунно-медиираното възпаление не са независими единици, а действат заедно като устройства за ранно предупреждение. Въпреки това, периферната нервна система също играе важна роля в патофизиологията и може би етиологията на много имунни заболявания като астма, псориазис или колит, тъй като способността й да активира имунната система може да засили патологичното възпаление 15. Следователно може да се наложи лечението на имунни нарушения да включва насочване на ноцицепторите, както и на имунните клетки.
Благодарности
Благодарим на NIH за подкрепата (2R37NS039518).
В заключение,Разбирането на ролята на неврогенното възпаление, когато става въпрос за защита на гостоприемника и имунопатология, е от съществено значение за определяне на правилния подход за лечение на различни здравни проблеми на нервната система. Разглеждайки взаимодействията на периферните неврони с имунните клетки, здравните специалисти могат да усъвършенстват терапевтичните подходи, за да помогнат допълнително за повишаване на защитата на гостоприемника, както и за потискане на имунопатологията. Целта на статията по-горе е да помогне на пациентите да разберат клиничната неврофизиология на невропатията, наред с други здравни проблеми с увреждане на нервите. Информация, посочена от Националния център за биотехнологична информация (NCBI). Обхватът на нашата информация е ограничен до хиропрактика, както и до наранявания и състояния на гръбначния стълб. За да обсъдите темата, моля, не се колебайте да попитате д-р Хименес или да се свържете с нас на 915-850-0900 .
Подготвен от д-р Алекс Хименес
Допълнителни теми: Болка в гърба
Заболявания на опорно-двигателния апарат е една от най-разпространените причини за инвалидност и пропуснати дни по време на работа в световен мащаб. Всъщност, болката в гърба е приписана като втората най-често срещана причина за посещенията в лекарски кабинети, превишаващи броя им само чрез инфекции на горните дихателни пътища. Приблизително 80 процента от населението ще преживее някакъв вид болка в гърба поне веднъж през целия си живот. Гърбът е сложна структура, съставена от кости, стави, връзки и мускули, сред другите меки тъкани. Поради това, наранявания и / или влошени условия, като например херния дискове, може евентуално да доведе до симптоми на болки в гърба. Спортни наранявания или наранявания при автомобилни аварии често са най-честата причина за болки в гърба, но понякога най-простите от движенията могат да имат болезнени резултати. За щастие алтернативните възможности за лечение, като хиропрактика, могат да помогнат за облекчаване на болката в гърба чрез използване на корекции на гръбначния стълб и ръчни манипулации, като в крайна сметка подобряват облекчаването на болката.

ВАЖНА ТЕМА: Намаляване на болката в гърба
ОЩЕ ТЕМИ: ДОПЪЛНИТЕЛНО: Хронична болка и лечение
празно
Препратки
Затворете акордеон
Професионален обхват на практика *
Информацията тук на "Ролята на неврогенните възпаления" няма за цел да замени личната връзка с квалифициран здравен специалист или лицензиран лекар и не е медицински съвет. Насърчаваме ви да вземате здравни решения въз основа на вашите изследвания и партньорство с квалифициран здравен специалист.
Информация за блога и дискусии за обхват
Нашият информационен обхват е ограничено до хиропрактика, мускулно-скелетни, физически лекарства, уелнес, допринасящи етиологични висцерозоматични нарушения в рамките на клинични презентации, свързана соматовисцерална рефлексна клинична динамика, сублуксационни комплекси, чувствителни здравни проблеми и/или статии, теми и дискусии от функционална медицина.
Ние предоставяме и представяме клинично сътрудничество със специалисти от различни дисциплини. Всеки специалист се ръководи от своя професионален обхват на практика и своята юрисдикция за лицензиране. Използваме протоколи за функционално здраве и уелнес за лечение и поддържане на грижи за наранявания или нарушения на мускулно-скелетната система.
Нашите видеоклипове, публикации, теми, теми и прозрения обхващат клинични въпроси, проблеми и теми, които се отнасят до и пряко или косвено подкрепят нашия клиничен обхват на практика.*
Нашият офис разумно се е опитал да предостави подкрепящи цитати и е идентифицирал съответното научно изследване или проучвания, подкрепящи нашите публикации. Ние предоставяме копия на подкрепящи научни изследвания, достъпни за регулаторните съвети и обществеността при поискване.
Разбираме, че обхващаме въпроси, които изискват допълнително обяснение как може да подпомогне определен план за грижи или протокол за лечение; следователно, за да обсъдите допълнително темата по-горе, моля не се колебайте да попитате Д-р Алекс Хименес, окръг Колумбия, Или се свържете с нас на адрес 915-850-0900.
Ние сме тук, за да помогнем на вас и вашето семейство.
Благословения
Д-р Алекс Хименес н.е., MSACP, RN*, CCST, IFMCP*, CIFM*, ATN*
имейл: coach@elpasofunctionalmedicine.com
Лицензиран като доктор по хиропрактика (DC) в Тексас & Ню Мексико*
Тексас DC Лиценз # TX5807, Ню Мексико DC Лиценз # NM-DC2182
Лицензирана като регистрирана медицинска сестра (RN*) in Флорида
Флорида Лиценз RN Лиценз # RN9617241 (Контролен номер 3558029)
Компактен статус: Многодържавен лиценз: Упълномощен да практикува в 40 състояния*
Д-р Алекс Хименес DC, MSACP, RN* CIFM*, IFMCP*, ATN*, CCST
Моята цифрова визитка