Биохимия на болката: Всички болкови синдроми имат профил на възпаление. Профилът на възпаление може да варира от човек на човек и може да варира при един човек в различно време. Лечението на болковите синдроми е да се разбере този профил на възпаление. Болковите синдроми се лекуват медикаментозно, хирургично или и двете. Целта е да се инхибира/подтиска производството на възпалителни медиатори. И успешният резултат е този, който води до по-малко възпаление и разбира се по-малко болка.
Съдържание
Биохимия на болката
Цели:
- Кои са основните играчи
- Какви са биохимичните механизми?
- Какви са последствията?
Преглед на възпалението:
Ключови играчи
 Защо ме боли рамото? Преглед на невроанатомичната и биохимичната основа на болката в рамото
Защо ме боли рамото? Преглед на невроанатомичната и биохимичната основа на болката в рамото
Резюме
Ако пациент попита „защо ме боли рамото?“, разговорът бързо ще се обърне към научна теория и понякога необосновани предположения. Често клиницистът осъзнава границите на научната основа на тяхното обяснение, демонстрирайки непълнотата на нашето разбиране за природата на болката в рамото. Този преглед използва систематичен подход, за да помогне да се отговори на основни въпроси, свързани с болката в рамото, с оглед да се даде представа за бъдещи изследвания и нови методи за лечение на болка в рамото. Ще изследваме ролите на (1) периферните рецептори, (2) обработката на периферната болка или „ноцицепцията“, (3) гръбначния мозък, (4) мозъка, (5) местоположението на рецепторите в рамото и (6) ) невронната анатомия на рамото. Ние също така разглеждаме как тези фактори могат да допринесат за вариабилността в клиничната картина, диагнозата и лечението на болката в рамото. По този начин ние се стремим да предоставим преглед на съставните части на периферната система за откриване на болка и централните механизми за обработка на болката при болка в рамото, които взаимодействат, за да предизвикат клинична болка.
ВЪВЕДЕНИЕ: МНОГО КРАТКА ИСТОРИЯ НА НАУКАТА ЗА БОЛКАТА, ОТ съществено значение за клиницистите
Естеството на болката като цяло е било предмет на много спорове през последния век. В теорията на Декарт от 17-ти век1 предлага, че интензивността на болката е пряко свързана с количеството свързано тъканно увреждане и че болката се обработва по един отделен път. Много по-ранни теории разчитаха на тази така наречена „дуалистична” декартова философия, виждайки болката като последица от стимулирането на „специфичен” периферен болков рецептор в мозъка. През 20-ти век последва научна битка между две противоположни теории, а именно теория на специфичността и теория на моделите. Декартовата „теория за специфичността“ разглежда болката като специфична отделна модалност на сензорния вход със собствен апарат, докато „теорията на моделите“ смята, че болката е резултат от интензивното стимулиране на неспецифични рецептори.2 През 1965 г. Wall and Melzack's 3 теорията на вратата на болката предостави доказателства за модел, при който възприятието на болката се модулира както от сензорната обратна връзка, така и от централната нервна система. Друг огромен напредък в теорията за болката приблизително по същото време е откриването на специфичния начин на действие на опиоидите.4 Впоследствие последните постижения в невровизуализацията и молекулярната медицина значително разшириха цялостното ни разбиране за болката.
И така, как това се отнася до болката в рамото? Болката в рамото е често срещан клиничен проблеми ясното разбиране на начина, по който болката се обработва от тялото, е от съществено значение за най-добрата диагноза и лечение на болката на пациента. Напредъкът в познанията ни за обработката на болката обещава да обясни несъответствието между патологията и възприемането на болката, те също могат да ни помогнат да обясним защо определени пациенти не реагират на определени лечения.
ОСНОВНИ СТРОИТЕЛНИ КОМПЛЕКТ НА БОЛКАТА
Периферни сензорни рецептори: механорецептор и ноцицептор
Има много видове периферни сензорни рецептори, присъстващи в мускулно-скелетната система на човека. 5 Те могат да бъдат класифицирани въз основа на тяхната функция (като механорецептори, терморецептори или ноцицептори) или морфология (свободни нервни окончания или различни видове капсулирани рецептори).5 След това различните типове рецептори могат да бъдат допълнително подкласифицирани въз основа на наличието на определени химически маркери. Има значителни припокривания между различните функционални класове рецептори, например
Обработка на периферна болка: „Ноцицепция“.
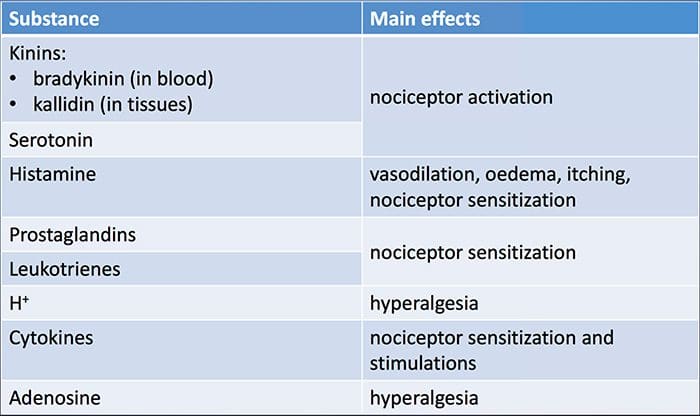
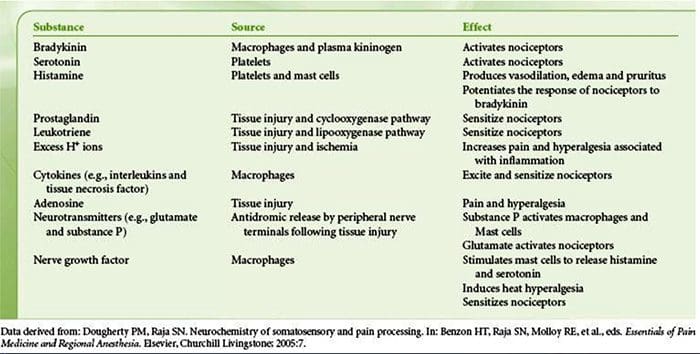
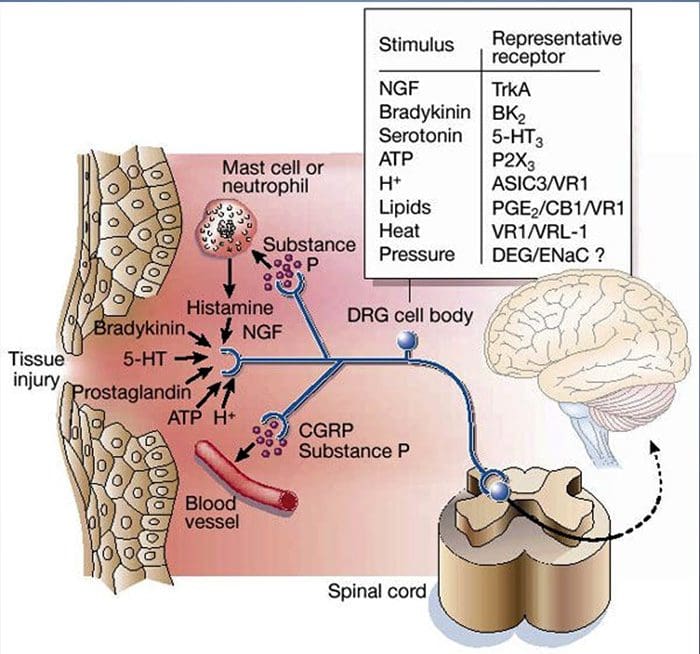
Увреждането на тъканите включва различни възпалителни медиатори, които се освобождават от увредените клетки, включително брадикинин, хистамин, 5-хидрокситриптамин, АТФ, азотен оксид и определени йони (K+ и H+). Активирането на пътя на арахидоновата киселина води до производството на простагландини, тромбоксани и левкотриени. Цитокините, включително интерлевкините и факторът на туморна некроза α, и невротрофините, като фактор на растежа на нервите (NGF), също се освобождават и участват непосредствено в улесняването на възпалението.15 Други вещества като възбуждащи аминокиселини (глутамат) и опиоиди ( ендотелин-1) също са замесени в острия възпалителен отговор.16 17 Някои от тези агенти могат директно да активират ноцицепторите, докато други водят до набирането на други клетки, които след това освобождават допълнителни улесняващи агенти.18 Този локален процес води до повишена отзивчивост на ноцицептивните неврони към нормалния им вход и/или набирането на отговор към нормално подпраговите входове се нарича „периферна сенсибилизация“. Фигура 1 обобщава някои от ключовите механизми.
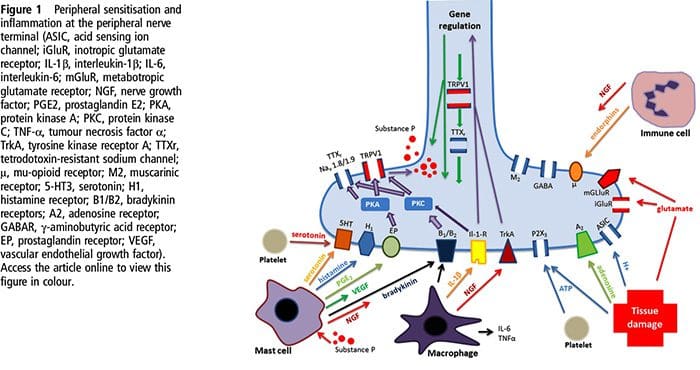 NGF и рецептора на подфамилията V на член 1 на катионния канал на преходния рецептор (TRPV1) имат симбиотична връзка, когато става въпрос за възпаление и сенсибилизация на ноцицептор. Цитокините, произведени в възпалената тъкан, водят до увеличаване на производството на NGF.19 NGF стимулира освобождаването на хистамин и серотонин (5-HT3) от мастоцитите, а също така сенсибилизира ноцицепторите, вероятно променяйки свойствата на A? влакна, така че по-голяма част от тях стават ноцицептивни. TRPV1 рецепторът присъства в субпопулация от първични аферентни влакна и се активира от капсаицин, топлина и протони. TRPV1 рецепторът се синтезира в клетъчното тяло на аферентното влакно и се транспортира както до периферните, така и до централните терминали, където допринася за чувствителността на ноцицептивните аференти. Възпалението води до периферно производство на NGF, който след това се свързва с рецептора на тирозин киназа тип 1 на ноцицепторните терминали, след това NGF се транспортира до клетъчното тяло, където води до повишена регулация на транскрипцията на TRPV1 и следователно повишена чувствителност на ноцицептора.19 20 NGF и други възпалителни медиатори също сенсибилизират TRPV1 чрез разнообразен набор от вторични предавателни пътища. Много други рецептори, включително холинергични рецептори, рецептори на а-аминомаслена киселина (GABA) и соматостатинови рецептори, също се смята, че участват в чувствителността на периферните ноцицептори.
NGF и рецептора на подфамилията V на член 1 на катионния канал на преходния рецептор (TRPV1) имат симбиотична връзка, когато става въпрос за възпаление и сенсибилизация на ноцицептор. Цитокините, произведени в възпалената тъкан, водят до увеличаване на производството на NGF.19 NGF стимулира освобождаването на хистамин и серотонин (5-HT3) от мастоцитите, а също така сенсибилизира ноцицепторите, вероятно променяйки свойствата на A? влакна, така че по-голяма част от тях стават ноцицептивни. TRPV1 рецепторът присъства в субпопулация от първични аферентни влакна и се активира от капсаицин, топлина и протони. TRPV1 рецепторът се синтезира в клетъчното тяло на аферентното влакно и се транспортира както до периферните, така и до централните терминали, където допринася за чувствителността на ноцицептивните аференти. Възпалението води до периферно производство на NGF, който след това се свързва с рецептора на тирозин киназа тип 1 на ноцицепторните терминали, след това NGF се транспортира до клетъчното тяло, където води до повишена регулация на транскрипцията на TRPV1 и следователно повишена чувствителност на ноцицептора.19 20 NGF и други възпалителни медиатори също сенсибилизират TRPV1 чрез разнообразен набор от вторични предавателни пътища. Много други рецептори, включително холинергични рецептори, рецептори на а-аминомаслена киселина (GABA) и соматостатинови рецептори, също се смята, че участват в чувствителността на периферните ноцицептори.
Голям брой възпалителни медиатори са специално замесени в болката в рамото и заболяването на ротаторния маншон.21 25 Докато някои химически медиатори директно активират ноцицепторите, повечето водят до промени в самия сензорен неврон, вместо директно да го активират. Тези промени могат да зависят от ранна посттранслация или от забавена транскрипция. Примери за първите са промени в TRPV1 рецептора или в волтаж-зависимите йонни канали в резултат на фосфорилирането на мембранно-свързани протеини. Примерите за последното включват индуцираното от NGF увеличаване на производството на TRV1 канал и индуцираното от калций активиране на вътреклетъчните транскрипционни фактори.
Молекулярни механизми на ноцицепцията
Усещането за болка ни предупреждава за истинско или предстоящо нараняване и предизвиква подходящи защитни реакции. За съжаление болката често надживява своята полезност като предупредителна система и вместо това става хронична и изтощаваща. Този преход към хронична фаза включва промени в гръбначния мозък и мозъка, но има и забележителна модулация, при която съобщенията за болка се инициират - на нивото на първичния сензорен неврон. Усилията да се определи как тези неврони откриват предизвикващи болка стимули от термична, механична или химична природа разкриха нови сигнални механизми и ни доближиха до разбирането на молекулярните събития, които улесняват преходите от остра към постоянна болка.
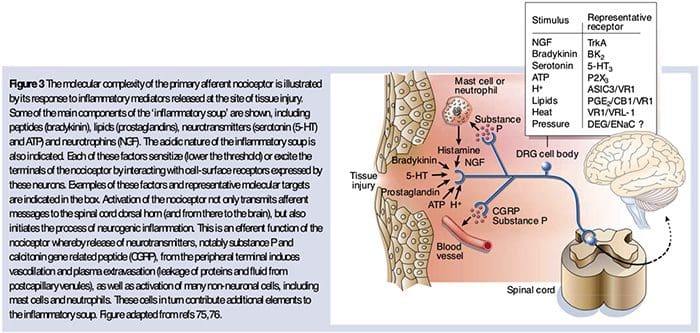 Неврохимията на ноцицепторите
Неврохимията на ноцицепторите
Глутаматът е преобладаващият възбуждащ невротрансмитер във всички ноцицептори. Хистохимичните изследвания на DRG при възрастни обаче разкриват два широки класа немиелинизирани C влакна.
Химически преобразуватели за влошаване на болката
Както е описано по-горе, нараняването засилва нашето усещане за болка, като повишава чувствителността на ноцицепторите както към термични, така и към механични стимули. Това явление е резултат отчасти от производството и освобождаването на химически медиатори от първичния сензорен терминал и от неневронни клетки (например фибробласти, мастоцити, неутрофили и тромбоцити) в околната среда36 (фиг. 3). Някои компоненти на възпалителната супа (например, протони, АТФ, серотонин или липиди) могат да променят възбудимостта на невроните директно чрез взаимодействие с йонните канали на повърхността на ноцицептора, докато други (например брадикинин и NGF) се свързват с метаботропните рецептори и медиират своите ефекти чрез сигнални каскади на втори пратеник11. Постигнат е значителен напредък в разбирането на биохимичната основа на такива модулиращи механизми.
Извънклетъчни протони и тъканна ацидоза
Локалната тъканна ацидоза е отличителен физиологичен отговор на нараняване и степента на свързаната болка или дискомфорт е добре свързана със степента на подкиселяване37. Прилагането на киселина (рН 5) върху кожата предизвиква продължителни изпускания в една трета или повече от полимодалните ноцицептори, които инервират рецептивното поле 20.
 Клетъчни и молекулярни механизми на болката
Клетъчни и молекулярни механизми на болката
абстрактен
Нервната система открива и интерпретира широк спектър от термични и механични стимули, както и екологични и ендогенни химически дразнители. Когато са интензивни, тези стимули генерират остра болка и в условията на продължително нараняване, компонентите на периферната и централната нервна система на пътя за предаване на болката проявяват огромна пластичност, засилвайки сигналите за болка и предизвиквайки свръхчувствителност. Когато пластичността улеснява защитните рефлекси, това може да бъде от полза, но когато промените продължават, може да се получи хронична болка. Генетичните, електрофизиологичните и фармакологичните изследвания изясняват молекулярните механизми, които са в основата на откриването, кодирането и модулирането на вредни стимули, които генерират болка.
Въведение: Остра срещу постоянна болка
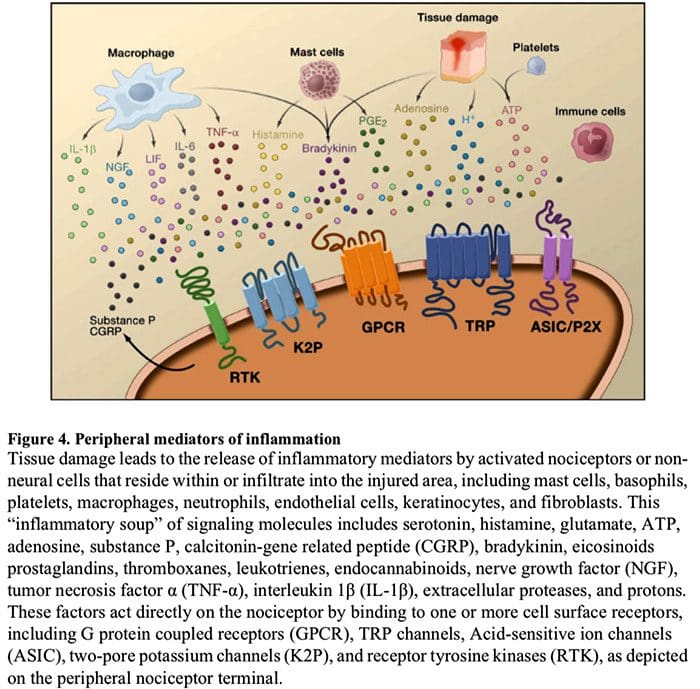
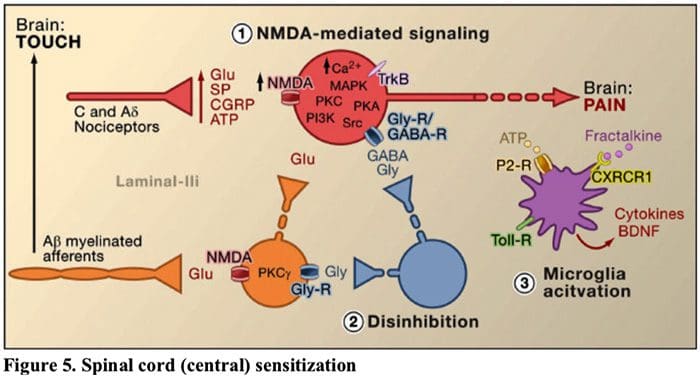 Фигура 5. Сенсибилизация на гръбначния мозък (централна).
Фигура 5. Сенсибилизация на гръбначния мозък (централна).
- Глутамат/NMDA рецептор-медиирана сенсибилизация. След интензивна стимулация или продължително нараняване, активирани C и A? ноцицепторите освобождават различни невротрансмитери, включително лутамат, субстанция P, пептид, свързан с калцитонин-гена (CGRP) и ATP, върху изходните неврони в ламина I на повърхностния гръбен рог (червен). В резултат на това нормално тихите NMDA глутаматни рецептори, разположени в постсинаптичния неврон, вече могат да сигнализират, да увеличат вътреклетъчния калций и да активират множество калций-зависими сигнални пътища и вторични посланици, включително митоген-активирана протеин киназа (MAPK), протеин киназа C (PKC) , протеин киназа А (PKA) и Src. Тази каскада от събития ще увеличи възбудимостта на изходния неврон и ще улесни предаването на съобщения за болка към мозъка.
- Дезинхибиране. При нормални обстоятелства инхибиторните интерневрони (сини) непрекъснато освобождават GABA и/или глицин (Gly), за да намалят възбудимостта на изходните неврони на ламина I и да модулират предаването на болката (инхибиторен тон). Въпреки това, в условията на нараняване, това инхибиране може да бъде загубено, което води до хипералгезия. Освен това деинхибирането може да даде възможност за неноцицептивен миелинизиран A? първични аференти за ангажиране на веригата за предаване на болката, така че нормално безобидните стимули сега да се възприемат като болезнени. Това се случва отчасти чрез деинхибирането на възбуждащия PKC? експресиращи интерневрони във вътрешната ламина II.
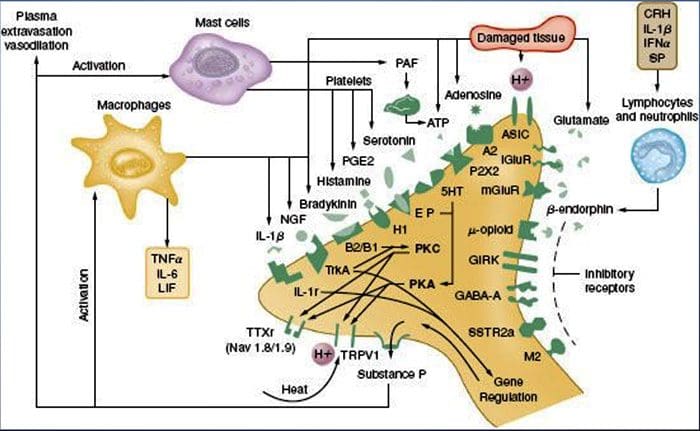
- Активиране на микроглии. Увреждането на периферните нерви насърчава освобождаването на АТФ и хемокина фракталкин, който ще стимулира микроглиалните клетки. По-специално, активирането на пуринергични, CX3CR1 и Toll-подобни рецептори върху микроглия (лилаво) води до освобождаване на мозъчен невротрофичен фактор (BDNF), който чрез активиране на TrkB рецептори, експресирани от изходни неврони на ламина I, насърчава повишена възбудимост и засилена болка в отговор както на вредна, така и на безобидна стимулация (тоест хипералгезия и алодиния). Активираната микроглия също освобождава множество цитокини, като тумор некрозис фактор ? (TNF?), интерлевкин-1? и 6 (IL-1?, IL-6) и други фактори, които допринасят за централната сенсибилизация.
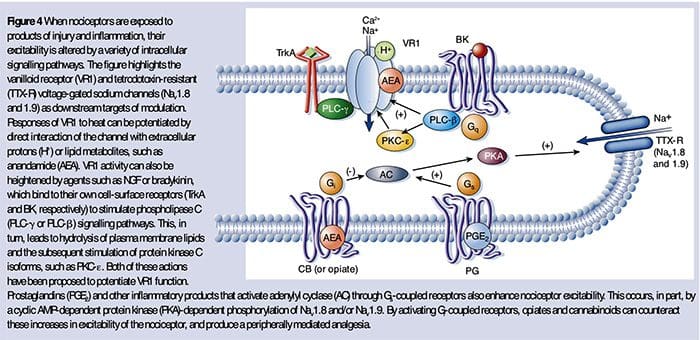
Химическата среда на възпалението
Периферната сенсибилизация по-често е резултат от свързани с възпаление промени в химическата среда на нервните влакна (McMahon et al., 2008). По този начин увреждането на тъканите често е придружено от натрупване на ендогенни фактори, освободени от активирани ноцицептори или не-невронни клетки, които се намират вътре или инфилтрират в увредената област (включително мастоцити, базофили, тромбоцити, макрофаги, неутрофили, ендотелни клетки, кератиноцити и фибробласти). Колективно. тези фактори, наричани „възпалителна супа“, представляват широк спектър от сигнални молекули, включително невротрансмитери, пептиди (вещество P, CGRP, брадикинин), ейкозиноиди и свързани липиди (простагландини, тромбоксани, левкотриени, ендоканабининоиди), невроканабининоиди и хемокини, както и извънклетъчни протеази и протони. Забележително е, че ноцицепторите експресират един или повече рецептори на клетъчната повърхност, способни да разпознават и реагират на всеки от тези про-възпалителни или про-алгетични агенти (Фигура 4). Такива взаимодействия повишават възбудимостта на нервното влакно, като по този начин повишават неговата чувствителност към температура или допир.
Безспорно най-често срещаният подход за намаляване на възпалителната болка включва инхибиране на синтеза или натрупването на компоненти на възпалителната супа. Това е най-добре илюстрирано от нестероидни противовъзпалителни лекарства, като аспирин или ибупрофен, които намаляват възпалителната болка и хипералгезията чрез инхибиране на циклооксигеназите (Cox-1 и Cox-2), участващи в синтеза на простагландин. Втори подход е да се блокират действията на възпалителни агенти в ноцицептора. Тук ние подчертаваме примери, които предоставят нов поглед върху клетъчните механизми на периферна сенсибилизация или които формират основата на нови терапевтични стратегии за лечение на възпалителна болка.
NGF е може би най-известен с ролята си на невротрофичен фактор, необходим за оцеляването и развитието на сензорните неврони по време на ембриогенезата, но при възрастни, NGF също се произвежда в условията на увреждане на тъканите и представлява важен компонент на възпалителната супа (Ritner et. др., 2009). Сред многобройните си клетъчни мишени, NGF действа директно върху пептидергичните C влакна ноцицептори, които експресират високоафинитетната NGF рецепторна тирозин киназа, TrkA, както и невротрофиновия рецептор с нисък афинитет, p75 (Chao, 2003; Snider and McMahon, 1998). NGF произвежда дълбока свръхчувствителност към топлина и механични стимули чрез два временно различни механизма. Първоначално взаимодействието на NGF-TrkA активира сигналните пътища надолу по веригата, включително фосфолипаза С (PLC), митоген-активирана протеин киназа (MAPK) и фосфоинозитид 3-киназа (PI3K). Това води до функционално потенциране на целевите протеини в периферния ноцицепторен терминал, най-вече TRPV1, което води до бърза промяна в клетъчната и поведенческата топлинна чувствителност (Chuang et al., 2001).
Независимо от техните про-ноцицептивни механизми, намесата в сигнализирането на невротрофини или цитокини се превърна в основна стратегия за контролиране на възпалителното заболяване или произтичащата от това болка. Основният подход включва блокиране на NGF или TNF-? действие с неутрализиращо антитяло. В случая на TNF-?, това е забележително ефективно при лечението на множество автоимунни заболявания, включително ревматоиден артрит, което води до драматично намаляване както на разрушаването на тъканите, така и на съпътстващата хипералгезия (Atzeni et al., 2005). Тъй като основните действия на NGF върху възрастния ноцицептор се проявяват в условията на възпаление, предимството на този подход е, че хипералгезията ще намалее, без да повлияе нормално възприемане на болката. Наистина, анти-NGF антителата в момента са в клинични изпитвания за лечение на синдроми на възпалителна болка (Hefti et al., 2006).
Сенсибилизация, медиирана от глутамат/NMDA рецептор
Острата болка се сигнализира от освобождаването на глутамат от централните терминали на ноцицепторите, генериращи възбуждащи постсинаптични токове (EPSCs) в невроните на дорзалния рог от втори ред. Това се случва главно чрез активиране на постсинаптичните AMPA и каинатни подтипове на йонотропните глутаматни рецептори. Сумирането на подпраговите EPSCs в постсинаптичния неврон в крайна сметка ще доведе до изстрелване на потенциала на действие и предаване на съобщението за болка към неврони от по-висок порядък.
Други проучвания показват, че промените в проекционния неврон сами по себе си допринасят за инхибиторния процес. Например, увреждането на периферния нерв дълбоко регулира надолу K+- Cl- ко-транспортер KCC2, който е от съществено значение за поддържане на нормални K+ и Cl- градиенти през плазмената мембрана (Coull et al., 2003). Понижаването на KCC2, който се експресира в невроните на ламина I проекция, води до изместване в Cl-градиента, така че активирането на GABA-A рецепторите деполяризира, а не хиперполяризира невроните на проекцията на ламина I. Това от своя страна ще повиши възбудимостта и ще увеличи предаването на болката. Действително, фармакологичната блокада или siRNA-медиираната регулация на KCC2 при плъхове предизвиква механична алодиния.
Източници:
Защо ме боли рамото? Преглед на невроанатомичната и биохимичната основа на болката в рамото
Бенджамин Джон Флойд Дийн, Стивън Едуард Гуилим, Андрю Джонатан Кар
Клетъчни и молекулярни механизми на болката
Алън И. Басбаум1, Даяна М. Баутиста2, Грегори Шерер1 и Дейвид Джулиус3
1 Катедра по анатомия, Калифорнийски университет, Сан Франциско 94158
2Катедра по молекулярна и клетъчна биология, Калифорнийски университет, Бъркли, Калифорния 94720 3Катедра по физиология, Калифорнийски университет, Сан Франциско 94158
Молекулни механизми на ноцицепция
Дейвид Джулиъс* и Алън И. Басбаум
*Катедрата по клетъчна и молекулярна фармакология и Катедрите по анатомия и физиология и WM Keck Foundation Center for Integrative Neuroscience, University of California San Francisco, San Francisco, California 94143, USA (e-mail: julius@socrates.ucsf.edu)
Професионален обхват на практика *
Информацията тук на "Биохимия на болката" няма за цел да замени личната връзка с квалифициран здравен специалист или лицензиран лекар и не е медицински съвет. Насърчаваме ви да вземате здравни решения въз основа на вашите изследвания и партньорство с квалифициран здравен специалист.
Информация за блога и дискусии за обхват
Нашият информационен обхват е ограничено до хиропрактика, мускулно-скелетни, физически лекарства, уелнес, допринасящи етиологични висцерозоматични нарушения в рамките на клинични презентации, свързана соматовисцерална рефлексна клинична динамика, сублуксационни комплекси, чувствителни здравни проблеми и/или статии, теми и дискусии от функционална медицина.
Ние предоставяме и представяме клинично сътрудничество със специалисти от различни дисциплини. Всеки специалист се ръководи от своя професионален обхват на практика и своята юрисдикция за лицензиране. Използваме протоколи за функционално здраве и уелнес за лечение и поддържане на грижи за наранявания или нарушения на мускулно-скелетната система.
Нашите видеоклипове, публикации, теми, теми и прозрения обхващат клинични въпроси, проблеми и теми, които се отнасят до и пряко или косвено подкрепят нашия клиничен обхват на практика.*
Нашият офис разумно се е опитал да предостави подкрепящи цитати и е идентифицирал съответното научно изследване или проучвания, подкрепящи нашите публикации. Ние предоставяме копия на подкрепящи научни изследвания, достъпни за регулаторните съвети и обществеността при поискване.
Разбираме, че обхващаме въпроси, които изискват допълнително обяснение как може да подпомогне определен план за грижи или протокол за лечение; следователно, за да обсъдите допълнително темата по-горе, моля не се колебайте да попитате Д-р Алекс Хименес, окръг Колумбия, Или се свържете с нас на адрес 915-850-0900.
Ние сме тук, за да помогнем на вас и вашето семейство.
Благословения
Д-р Алекс Хименес н.е., MSACP, RN*, CCST, IFMCP*, CIFM*, ATN*
имейл: coach@elpasofunctionalmedicine.com
Лицензиран като доктор по хиропрактика (DC) в Тексас & Ню Мексико*
Тексас DC Лиценз # TX5807, Ню Мексико DC Лиценз # NM-DC2182
Лицензирана като регистрирана медицинска сестра (RN*) in Флорида
Флорида Лиценз RN Лиценз # RN9617241 (Контролен номер 3558029)
Компактен статус: Многодържавен лиценз: Упълномощен да практикува в 40 състояния*
Д-р Алекс Хименес DC, MSACP, RN* CIFM*, IFMCP*, ATN*, CCST
Моята цифрова визитка







